よむ、つかう、まなぶ。
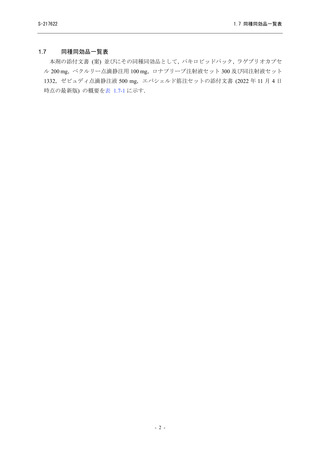
【資料No.1】1.7_同種同効品一覧表 (32 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_29325.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会(令和4年度第5回 11/22)、医薬品第二部会(令和4年度第13回 11/22)(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
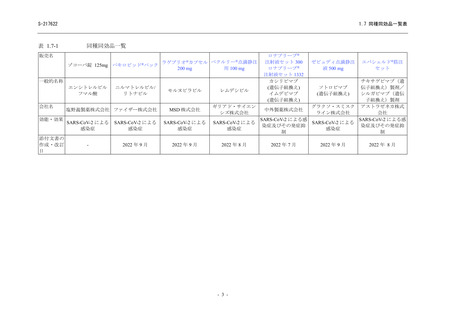
表174 主な選択・除外基準
選択基準
なお、
本試験の主な選択・除外基準は表176のとおりであった。
表176 主な選択・除外基準
1.
以下のいずれかに該当する
(
a)
以下の要因を有するワクチンの効果が不十分と考えられ
選択基準
1.
登録時点で、検査でSARSCoV2感染が確認された者(症状
る又は接種が推奨されない者
の有無は問わない)に8日以内に接触した可能性があり、
・60歳以上
SARSCoV2による感染症を発症する差し迫ったリスクを
・肥満(BMI
30kg/
m2以上)
有する(以下に該当する者と定義)
・うっ血性心不全
・長期療養施設(高度看護施設、介護施設、高齢者用住宅等)の
・慢性閉塞性肺疾患
入居者、
医療従事者及びその他の職員
・慢性腎臓病(GFR30mL/
分/
1.
73m2未満)
・SARSCoV2感染リスクの高い業種に従事する者(食肉加
・慢性肝疾患
工工場等)
・免疫抑制状態(固形臓器移植、血液又は骨髄移植、免疫不
・軍関係の施設(兵舎、軍用艦、狭い職場環境等)にいる軍人及
全症、HI
V、コルチコステロイド又はその他の免疫抑制剤
び一般市民
の使用)
・医療施設の医療従事者及びその他の職員
・既承認のワクチンに対して重度の有害事象又は重篤な有
・寄宿生活を行う学生
害事象の既往歴がある
・初発患者と同居している者を含む家庭内接触者
(
b)
以下に該当するSARSCoV2感染リスクが高い場所又
・その他、
同様に接近した又は混雑した環境にいる者
は状況に置かれる者
2.
治験薬投与前10日以内にSARSCoV2による感染症の症
・長期療養施設(高度看護施設、介護施設、高齢者用住宅等)
状がない
の職員を含む医療従事者
3.
スクリーニング時にSARSCoV2血清学的検査が陰性であ
・SARSCoV2感染リスクの高い業種に従事する者(食肉
る
加工工場等)
除外基準
1.
スクリーニング時に、SARSCoV2感染又はSARSCoV2
・混雑した環境(兵舎、軍用艦、狭い職場環境等)で居住又は
抗体陽性の既往がある
労働を行う軍人
2.
SARSCoV2による感染症に対するワクチン、モノクロー
・寄宿生活を行う学生
ナル抗体又は生物学的製剤(承認の有無を問わない)の接種
・その他、
同様に接近した又は混雑した環境で生活する者
歴若しくは投与歴がある、又は追跡期間中に接種若しくは
2.
スクリーニング時にSARSCoV2血清学的検査が陰性であ
投与する予定がある
る
除外基準
3.
組入れ前1カ月以内に基礎疾患の悪化による治療法の重大
本剤群の追加解析時点(投与後追跡期間の中央値は121日)の副作
な変更又は入院がなく、組入れ時に状態の急激な変化がな
用の発現割合は4.
5%
(34/749例)であり、発現割合が1%以上の副
いと治験責任(分担)
医師により判断される
作用は頭痛1.
2%
(9/
749例)
であった。
1.
無作為化の前日又は当日に、発熱(37.
8˚
C超)を含む重大な
18.薬効薬理
感染症又はその他の急性疾患がある
2.
スクリーニング時に、SARSCoV2感染又はSARSCoV2
18.
1 作用機序
チキサゲビマブ及びシルガビマブは、SARSCoV2ウイルスのス
抗体陽性の既往がある
3.
SARSCoV2による感染症に対するワクチン、モノクロー
パイクタンパク質の受容体結合ドメイン(RBD)上の各抗体が互
ナル抗体又は生物学的製剤(承認の有無を問わない)の接種
いに重複しない部位に同時に結合し、SARSCoV2に対する中和
歴若しくは投与歴がある、又は追跡期間中に接種若しくは
n vi
t
r
oにおいて、抗体依存性細胞傷害
作用を示す8),9),10)。なお、i
投与する予定がある
(ADCC)、抗体依存性細胞貪食(ADCP)、抗体依存性補体沈着
本剤群の追加解析時点(投与後追跡期間の中央値は137日)の副作
(ADCD)及び抗体依存性ナチュラルキラー細胞活性(ADNKA)
用の発現割合は8.
5%
(293/3461例)であり、発現割合が1%以上
の副作用は頭痛1.
7%
(59/3461例)及び疲労1.
2%
(43/3461例)で
11)
。
はほぼ認められなかった8),
18.
2I
n vi
t
r
oにおけるウイルス中和活性
あった。
野生型のSARSCoV2の臨床分離株(USAW A1/2020株)に対
17.
1.
3海外第I
I
I
相試験
(STORM CHASER試験)
して、チキサゲビマブ及びシルガビマブ併用は濃度依存的な中和
SARSCoV2感染者と接触した可能性があり、SARSCoV2に
作用を示し、50%有効濃度(EC50)は10ng/mLであった(Ver
o E6
よる感染症を発症するリスクがある18歳以上の被験者を対象と
8)
,
12)
細胞)
。
したプラセボ対照無作為化二重盲検並行群間比較試験 7)であり、
al
pha株(B.
1.
1.
7系統)、bet
a株(B.
1.
351系統)、gamma株(P.
1系
本剤300mg
(チキサゲビマブ150mg及びシルガビマブ150mgを
統)、del
t
a株(B.
1.
617.
2系統)、i
ot
a株(B.
1.
526系統)、kappa株
逐次投与)又はプラセボを単回筋肉内投与した。主要評価項目は、
(B.
1.
617.
1系統)及びeps
i
l
on株(B.
1.
427/B.
1.
429系統)の臨床分
治験薬投与後183日目までのSARSCoV2による感染症の症状
離株に対して、チキサゲビマブ及びシルガビマブ併用の中和活性
の発現、かつRTPCR陽性の確認(イベント)に基づく相対リスク
pha株(B.
1.
1.
7
3〜3.
8倍であった13)。また、al
のEC50は野生型の0.
減少率[(1−本剤群のイベント発現割合/
プラセボ群のイベント発
系統)、bet
a株(B.
1.
351系統)、gamma株(P.
1系統)、del
t
a株
現割合)
×100]であった。
(B.
1.
617.
2、AY.
1/AY.
2系統)、et
a株(B.
1.
525系統)、i
ot
a株
主要解析(投与後追跡期間の中央値は本剤群49日、プラセボ群48
(B.
1.
526系統)、kappa株(B.
1.
617.
1系統)、l
ambda株(C.
37系
日)では、全体集団(FAS)において、イベント発現割合は本剤群
統)、mu株(B.
1.
621系統)、eps
i
l
on株(B.
1.
427/B.
1.
429 系統)及
3.
1%
(23/749例)、プラセボ群4.
6%
(17/372例)であり、相対リス
びzet
a株(P.
2系統)のスパイクタンパク質の主要変異を有する
ク減少率は33%
(95%信頼区間:26%,65%)であった(p =
シュードウイルス粒子に対して、チキサゲビマブ及びシルガビマ
0.
212)。
7〜7.
5倍であった13)。
ブ併用の中和活性のEC50は野生型の0.
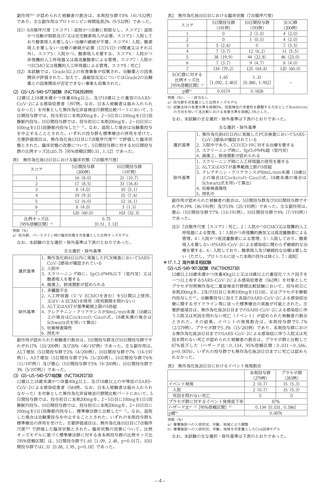
表175 主要評価項目に対する有効性
(主要解析)
イベント発現割合
Omi
cr
on株(B.
1.
1.
529系統)のうち、BA.
1、BA.
1.
1及び BA.
2系
本剤300mg群
プラセボ群
統の臨床分離株に対して、チキサゲビマブ及びシルガビマブ併用
3.
1%
(23/
749例)
4.
6%
(17/
372例)
の中和活性のEC50はそれぞれ野生型の12〜30、176及び5.
4倍で
相対リスク減少率注1)
33%
(95%信頼区間:26%,65%)
あった14)。また、BA.
1、BA.
1.
1、BA.
2、BA.
2.
12.
1、BA.
3及びBA.
4
p値注2)
0.
212
/BA.
5系統のスパイクタンパク質の主要変異を有するシュードウ
注1)投与群を共変量、追跡期間の対数変換値をオフセット変数としたロバス
イルス粒子に対して、チキサゲビマブ及びシルガビマブ併用の中
ト分散を用いたポアソン回帰モデルにより推定
和活性のEC50はそれぞれ野生型の132〜183、424、3.
2、5、16及
注2)
有意水準両側5%
び33〜65倍であった14)。
−4−
選択基準
なお、
本試験の主な選択・除外基準は表176のとおりであった。
表176 主な選択・除外基準
1.
以下のいずれかに該当する
(
a)
以下の要因を有するワクチンの効果が不十分と考えられ
選択基準
1.
登録時点で、検査でSARSCoV2感染が確認された者(症状
る又は接種が推奨されない者
の有無は問わない)に8日以内に接触した可能性があり、
・60歳以上
SARSCoV2による感染症を発症する差し迫ったリスクを
・肥満(BMI
30kg/
m2以上)
有する(以下に該当する者と定義)
・うっ血性心不全
・長期療養施設(高度看護施設、介護施設、高齢者用住宅等)の
・慢性閉塞性肺疾患
入居者、
医療従事者及びその他の職員
・慢性腎臓病(GFR30mL/
分/
1.
73m2未満)
・SARSCoV2感染リスクの高い業種に従事する者(食肉加
・慢性肝疾患
工工場等)
・免疫抑制状態(固形臓器移植、血液又は骨髄移植、免疫不
・軍関係の施設(兵舎、軍用艦、狭い職場環境等)にいる軍人及
全症、HI
V、コルチコステロイド又はその他の免疫抑制剤
び一般市民
の使用)
・医療施設の医療従事者及びその他の職員
・既承認のワクチンに対して重度の有害事象又は重篤な有
・寄宿生活を行う学生
害事象の既往歴がある
・初発患者と同居している者を含む家庭内接触者
(
b)
以下に該当するSARSCoV2感染リスクが高い場所又
・その他、
同様に接近した又は混雑した環境にいる者
は状況に置かれる者
2.
治験薬投与前10日以内にSARSCoV2による感染症の症
・長期療養施設(高度看護施設、介護施設、高齢者用住宅等)
状がない
の職員を含む医療従事者
3.
スクリーニング時にSARSCoV2血清学的検査が陰性であ
・SARSCoV2感染リスクの高い業種に従事する者(食肉
る
加工工場等)
除外基準
1.
スクリーニング時に、SARSCoV2感染又はSARSCoV2
・混雑した環境(兵舎、軍用艦、狭い職場環境等)で居住又は
抗体陽性の既往がある
労働を行う軍人
2.
SARSCoV2による感染症に対するワクチン、モノクロー
・寄宿生活を行う学生
ナル抗体又は生物学的製剤(承認の有無を問わない)の接種
・その他、
同様に接近した又は混雑した環境で生活する者
歴若しくは投与歴がある、又は追跡期間中に接種若しくは
2.
スクリーニング時にSARSCoV2血清学的検査が陰性であ
投与する予定がある
る
除外基準
3.
組入れ前1カ月以内に基礎疾患の悪化による治療法の重大
本剤群の追加解析時点(投与後追跡期間の中央値は121日)の副作
な変更又は入院がなく、組入れ時に状態の急激な変化がな
用の発現割合は4.
5%
(34/749例)であり、発現割合が1%以上の副
いと治験責任(分担)
医師により判断される
作用は頭痛1.
2%
(9/
749例)
であった。
1.
無作為化の前日又は当日に、発熱(37.
8˚
C超)を含む重大な
18.薬効薬理
感染症又はその他の急性疾患がある
2.
スクリーニング時に、SARSCoV2感染又はSARSCoV2
18.
1 作用機序
チキサゲビマブ及びシルガビマブは、SARSCoV2ウイルスのス
抗体陽性の既往がある
3.
SARSCoV2による感染症に対するワクチン、モノクロー
パイクタンパク質の受容体結合ドメイン(RBD)上の各抗体が互
ナル抗体又は生物学的製剤(承認の有無を問わない)の接種
いに重複しない部位に同時に結合し、SARSCoV2に対する中和
歴若しくは投与歴がある、又は追跡期間中に接種若しくは
n vi
t
r
oにおいて、抗体依存性細胞傷害
作用を示す8),9),10)。なお、i
投与する予定がある
(ADCC)、抗体依存性細胞貪食(ADCP)、抗体依存性補体沈着
本剤群の追加解析時点(投与後追跡期間の中央値は137日)の副作
(ADCD)及び抗体依存性ナチュラルキラー細胞活性(ADNKA)
用の発現割合は8.
5%
(293/3461例)であり、発現割合が1%以上
の副作用は頭痛1.
7%
(59/3461例)及び疲労1.
2%
(43/3461例)で
11)
。
はほぼ認められなかった8),
18.
2I
n vi
t
r
oにおけるウイルス中和活性
あった。
野生型のSARSCoV2の臨床分離株(USAW A1/2020株)に対
17.
1.
3海外第I
I
I
相試験
(STORM CHASER試験)
して、チキサゲビマブ及びシルガビマブ併用は濃度依存的な中和
SARSCoV2感染者と接触した可能性があり、SARSCoV2に
作用を示し、50%有効濃度(EC50)は10ng/mLであった(Ver
o E6
よる感染症を発症するリスクがある18歳以上の被験者を対象と
8)
,
12)
細胞)
。
したプラセボ対照無作為化二重盲検並行群間比較試験 7)であり、
al
pha株(B.
1.
1.
7系統)、bet
a株(B.
1.
351系統)、gamma株(P.
1系
本剤300mg
(チキサゲビマブ150mg及びシルガビマブ150mgを
統)、del
t
a株(B.
1.
617.
2系統)、i
ot
a株(B.
1.
526系統)、kappa株
逐次投与)又はプラセボを単回筋肉内投与した。主要評価項目は、
(B.
1.
617.
1系統)及びeps
i
l
on株(B.
1.
427/B.
1.
429系統)の臨床分
治験薬投与後183日目までのSARSCoV2による感染症の症状
離株に対して、チキサゲビマブ及びシルガビマブ併用の中和活性
の発現、かつRTPCR陽性の確認(イベント)に基づく相対リスク
pha株(B.
1.
1.
7
3〜3.
8倍であった13)。また、al
のEC50は野生型の0.
減少率[(1−本剤群のイベント発現割合/
プラセボ群のイベント発
系統)、bet
a株(B.
1.
351系統)、gamma株(P.
1系統)、del
t
a株
現割合)
×100]であった。
(B.
1.
617.
2、AY.
1/AY.
2系統)、et
a株(B.
1.
525系統)、i
ot
a株
主要解析(投与後追跡期間の中央値は本剤群49日、プラセボ群48
(B.
1.
526系統)、kappa株(B.
1.
617.
1系統)、l
ambda株(C.
37系
日)では、全体集団(FAS)において、イベント発現割合は本剤群
統)、mu株(B.
1.
621系統)、eps
i
l
on株(B.
1.
427/B.
1.
429 系統)及
3.
1%
(23/749例)、プラセボ群4.
6%
(17/372例)であり、相対リス
びzet
a株(P.
2系統)のスパイクタンパク質の主要変異を有する
ク減少率は33%
(95%信頼区間:26%,65%)であった(p =
シュードウイルス粒子に対して、チキサゲビマブ及びシルガビマ
0.
212)。
7〜7.
5倍であった13)。
ブ併用の中和活性のEC50は野生型の0.
表175 主要評価項目に対する有効性
(主要解析)
イベント発現割合
Omi
cr
on株(B.
1.
1.
529系統)のうち、BA.
1、BA.
1.
1及び BA.
2系
本剤300mg群
プラセボ群
統の臨床分離株に対して、チキサゲビマブ及びシルガビマブ併用
3.
1%
(23/
749例)
4.
6%
(17/
372例)
の中和活性のEC50はそれぞれ野生型の12〜30、176及び5.
4倍で
相対リスク減少率注1)
33%
(95%信頼区間:26%,65%)
あった14)。また、BA.
1、BA.
1.
1、BA.
2、BA.
2.
12.
1、BA.
3及びBA.
4
p値注2)
0.
212
/BA.
5系統のスパイクタンパク質の主要変異を有するシュードウ
注1)投与群を共変量、追跡期間の対数変換値をオフセット変数としたロバス
イルス粒子に対して、チキサゲビマブ及びシルガビマブ併用の中
ト分散を用いたポアソン回帰モデルにより推定
和活性のEC50はそれぞれ野生型の132〜183、424、3.
2、5、16及
注2)
有意水準両側5%
び33〜65倍であった14)。
−4−