よむ、つかう、まなぶ。
【参考資料6】アルドシカ錠20mg並びにザルティア錠2.5mg及び同錠5mgの添付文書 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58149.html |
| 出典情報 | 医療用から要指導・一般用への転用に関する評価検討会議(第32回 5/23)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
17. 臨床成績
17.1 有効性及び安全性に関する試験
17.1.1 国内第TI相二重盲検比較了臨床試験
日本人の前立腺肥大症に伴う排尿障害患者 (422例) を対象にプラ
セボ、タダラフィル2.5mg又は5mgを1日1回12週間投与した結果、
IPSSトータルスコアのベースラインからの変化量 (最小二乗平均
値) はプラセボ群で-3.8、タダラフィル2.5mg群で-4.5、5mg群で
-4.9であった。 変化量のプラセボ群との差は、5mg群 (-1.1) が
2.5mg群 (-0.7) に比べて57%大きく、用量依存的な改善傾向が認
められため)。 (試験①)
副作用発現頻度は、タダラブィル2.5mg群で4.9% (7/142例) 及び
タダラフィル5mg群で6.49% (9/140例) であった。主な副作用は、
2.5mg群では、ほてりが2.1% (3/142例) 及び動怪が1.4% (2/142
例)、5mg群では、消化不良が2.1% (3/140例) 及びはほてりが1.4%
(2/140例) であった。
17.1.2 国際共同第息相二重盲検比較臨床試験
日本、韓国及び台湾の前立腺肥大症に伴う排尿障害患者 (309例)
を対象に、プラセボ又はタダラフィル5mgを1日1回12週間投与した
結果、IPSSトータルスコアのベースラインからの変化量 (最ホニニ
乗平均値) はプラセボ群で-3.0、タダラフィル5mg群で-4.7であり、
5mg群はプラセボ群と比較して統計学的に有意な改善を示した。
5mg群では投与2週後の早期からIPSSトータルスコアの改善が認め
られた%⑯。また、 日本人愚者 (173例) におけるIPSSトータルスコ
アのベースラインからの変化量 (最小二乗平均値) はプラセボ和群で
-3.1、タダラフィル5mg群で-4.8であり、5mg群はプラセボ群と比
較して統計学的に有意な改善を示した (プラセボ群との差:-1.7、
p=0.036)。 (試験②)
副作用発現頻度は、タダラフィル2.5mg群で9.9% (15/151例) 及
び5mg群で13.5% (21/155例) であった。主な副作用は、2.5mg和群
では、筋栖縮、筋肉痛及び頭痛が各1.3% (2/151例)、5mg群では、
筋肉痛が3.29% (5/155例)、消化不良、悪心、血中クレアチンホス
ホキナーゼ増加及び筋緊張が各1.39%。 (2/155例) であった。
17.1.3 国際共同第四相二重盲検比較臨床試験
日本及び韓国の前立腺肥大症に伴う排尿障害患者 (610例) を対象
に、プラセボ又はタダラフィル5mgを1日1回12週間投与した結果、
IPSSトータルスコアのベースラインからの変化量 (最小二乗平均値)
はプラセボ群で-4.5、タダラフィル5mg群で-6.0であり、5mg群は
プラセボ群と比較して統計学的に有意な改善を示した。5mg群では
投与4週後からIPSSトータルスコアの改善が認められたの⑰。また、
日本人愚者 (449例) におけるIPSSトータルスコアのベースライン
からの変化量 (最小二乗平均値) はプラセボ群で-4.8、タダラフィ
ル5mg群で-6.0であり、5mg群はプラセボ群と比較して統計学的に
有意な改善を示した (プラセボ群との差:-1.2、p=0.017)。 (試験③④)
副作用発現問度は、タダラフィル5mg群で15.0% (46/306例) で
あった。主な加作用は、消化不良が3.3% (10/306例)、頭痛が2.6%
(8/306例) 及び血中クレアチンホスホキナーゼ増加が2.0% (6/306
例) であった。
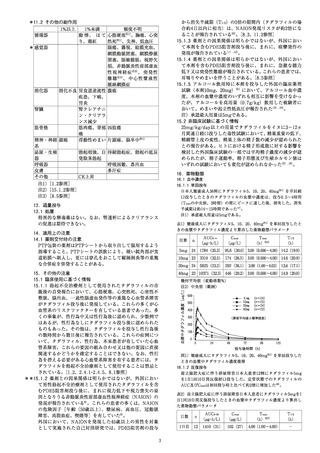
表1) IPSSトータルスコアの投与前後における変化量
、。 | 授与 変化量 こ
肖絡 | n 12 |
(平均値) | 平均値)
着き|140| 165 | 128 | -38 - -
隊氷肛験| 25mg |142| 163 | 120 | -45 | -07 |92m
護0) | sn。 |140| 164 | 17 | -49 | -11 |0062
第相| フラャ| 154| 168 | 136 | -30 - -
臨床試験
准) | 5mg |155| 172 | 122 | -47 | -17 | oo
第由相激 | プラセボ| 304| 187 | 139 | -45 - -
陸
(避) | 5mg |306| 187 | 121 | -60 | -15 |<oool
注1) 共分散分析モデル解析 (LOCFを使用)
注2) 経時測定データの混合効果モデル解析
の 4 8 12
0 1
四 -1 - ー@-プラセボ
司
ト _2 」 ー8ータダラフィル 5mg
NN Fキコ ※ま※ : pDく0.01
づ ] ま※※ : Dく0.001
|
め -4 - 玉来玉
ニ 玉来
づつ -] 素玉
づ - (最小二乗平均値 標準誤差)
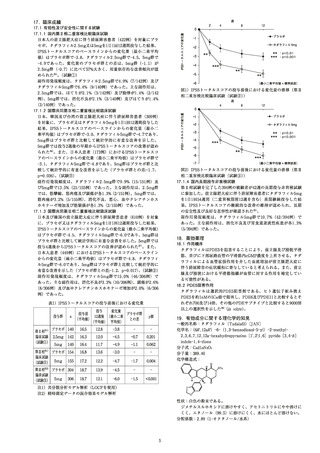
図1) IPSSトータルスコアの投与前後における変化量の推移 (第
相二重盲検比較臨床試験 (試験⑦) )
週
4 8 12
0 1 T
四 -1 - ー@- プラセボ
培
R -2 - ー@- タダラフィル 5mg
ロ
K づ - ※*※ : Dく0.01
避 前 まま※ : pく0.001
1 ] ※※玉
てう
を 。 つる]
ネネ
で] 玉素
ー7 - (最小二乗平均値 ょ 標準誤差)
図2) IPSSトータルスコアの投与前後における変化量の推移 (第想
相二重盲検比較了臨床試験 (試験③①) )
17.1.4 国内長期投与非盲検試験
第 相試験を完了した394例の被験者が42週の長期投与非盲検試験
に参加 した。 前立腺肥大症に伴う排尿障害患者にタダラフィル5mg
を1日1回54週間 (二重盲検期間12週を含む) 長期継続投与した結
果、IPSSトータルスコアの継続的な改善の維持が認められ、長期
の安全性及び良好な忍容性が確認きれため。
副作用発現頻度は、タダラフィル5mg群で10 .7% (42/394例) で
あった。主な加作用は、消化不良及び胃食道逆流性疾患が各1.3%
(5/394例) であった。
18. 薬効薬理
18.1 作用機序
タダラフィルはPDE5を阻害することにより、前立腺及び勝腕平滑
筋、並びに下部尿路血管の平滑筋内cGMP濃度を上昇させる。タダ
ラフィルによる血管拡張作用を介した血流増加が前立腺肥大症に
伴う排尿障害の症状緩和に寄与していると考えられる。また、前立
腺及び勝雄における平滑筋紀緩が血管に対する作用を補完してい
る可能性がある。
18.2 PDE5阻害作用
タダラフィルは選択的PDE5阻害剤である。ヒト遺伝子組み換え
PDE5を約1nMのICs値で阻害 し、PDE6及びPDE11と比較するとそ
れぞれ700及び14倍、その他のPDEサブタイプと比較すると9000倍
以上の選択性を示した9 (訪 婦みの)。
19. 有効成分に関する理化学的知見
一般的名称: タダラフィル (Tadalafil) [TAN]J
化学名 : (6Z,12aZ) -6- (1,3-benzodioxol-5-yl) -2-methyl-
2,3.6,7,12,12a-hexahydropyrazino [1,2:1.6] pyrido [3,4-ヵ]
indole-1 ,4-dione
分子式 : CgHnsNsO4
分子量 : 389.40
化学構造式 :
|
N
H ィ
H O
ie
性状 : 白色の粉末である。
ジメチルスルホキシドに溶けやすく、アセトニトリルにやや溶けに
くく、エタノール (99.5) に溶けにくく、水にほとんど溶けない。
分配係数 : 2.89 (1-オクタノール/水系)
17.1 有効性及び安全性に関する試験
17.1.1 国内第TI相二重盲検比較了臨床試験
日本人の前立腺肥大症に伴う排尿障害患者 (422例) を対象にプラ
セボ、タダラフィル2.5mg又は5mgを1日1回12週間投与した結果、
IPSSトータルスコアのベースラインからの変化量 (最小二乗平均
値) はプラセボ群で-3.8、タダラフィル2.5mg群で-4.5、5mg群で
-4.9であった。 変化量のプラセボ群との差は、5mg群 (-1.1) が
2.5mg群 (-0.7) に比べて57%大きく、用量依存的な改善傾向が認
められため)。 (試験①)
副作用発現頻度は、タダラブィル2.5mg群で4.9% (7/142例) 及び
タダラフィル5mg群で6.49% (9/140例) であった。主な副作用は、
2.5mg群では、ほてりが2.1% (3/142例) 及び動怪が1.4% (2/142
例)、5mg群では、消化不良が2.1% (3/140例) 及びはほてりが1.4%
(2/140例) であった。
17.1.2 国際共同第息相二重盲検比較臨床試験
日本、韓国及び台湾の前立腺肥大症に伴う排尿障害患者 (309例)
を対象に、プラセボ又はタダラフィル5mgを1日1回12週間投与した
結果、IPSSトータルスコアのベースラインからの変化量 (最ホニニ
乗平均値) はプラセボ群で-3.0、タダラフィル5mg群で-4.7であり、
5mg群はプラセボ群と比較して統計学的に有意な改善を示した。
5mg群では投与2週後の早期からIPSSトータルスコアの改善が認め
られた%⑯。また、 日本人愚者 (173例) におけるIPSSトータルスコ
アのベースラインからの変化量 (最小二乗平均値) はプラセボ和群で
-3.1、タダラフィル5mg群で-4.8であり、5mg群はプラセボ群と比
較して統計学的に有意な改善を示した (プラセボ群との差:-1.7、
p=0.036)。 (試験②)
副作用発現頻度は、タダラフィル2.5mg群で9.9% (15/151例) 及
び5mg群で13.5% (21/155例) であった。主な副作用は、2.5mg和群
では、筋栖縮、筋肉痛及び頭痛が各1.3% (2/151例)、5mg群では、
筋肉痛が3.29% (5/155例)、消化不良、悪心、血中クレアチンホス
ホキナーゼ増加及び筋緊張が各1.39%。 (2/155例) であった。
17.1.3 国際共同第四相二重盲検比較臨床試験
日本及び韓国の前立腺肥大症に伴う排尿障害患者 (610例) を対象
に、プラセボ又はタダラフィル5mgを1日1回12週間投与した結果、
IPSSトータルスコアのベースラインからの変化量 (最小二乗平均値)
はプラセボ群で-4.5、タダラフィル5mg群で-6.0であり、5mg群は
プラセボ群と比較して統計学的に有意な改善を示した。5mg群では
投与4週後からIPSSトータルスコアの改善が認められたの⑰。また、
日本人愚者 (449例) におけるIPSSトータルスコアのベースライン
からの変化量 (最小二乗平均値) はプラセボ群で-4.8、タダラフィ
ル5mg群で-6.0であり、5mg群はプラセボ群と比較して統計学的に
有意な改善を示した (プラセボ群との差:-1.2、p=0.017)。 (試験③④)
副作用発現問度は、タダラフィル5mg群で15.0% (46/306例) で
あった。主な加作用は、消化不良が3.3% (10/306例)、頭痛が2.6%
(8/306例) 及び血中クレアチンホスホキナーゼ増加が2.0% (6/306
例) であった。
表1) IPSSトータルスコアの投与前後における変化量
、。 | 授与 変化量 こ
肖絡 | n 12 |
(平均値) | 平均値)
着き|140| 165 | 128 | -38 - -
隊氷肛験| 25mg |142| 163 | 120 | -45 | -07 |92m
護0) | sn。 |140| 164 | 17 | -49 | -11 |0062
第相| フラャ| 154| 168 | 136 | -30 - -
臨床試験
准) | 5mg |155| 172 | 122 | -47 | -17 | oo
第由相激 | プラセボ| 304| 187 | 139 | -45 - -
陸
(避) | 5mg |306| 187 | 121 | -60 | -15 |<oool
注1) 共分散分析モデル解析 (LOCFを使用)
注2) 経時測定データの混合効果モデル解析
の 4 8 12
0 1
四 -1 - ー@-プラセボ
司
ト _2 」 ー8ータダラフィル 5mg
NN Fキコ ※ま※ : pDく0.01
づ ] ま※※ : Dく0.001
|
め -4 - 玉来玉
ニ 玉来
づつ -] 素玉
づ - (最小二乗平均値 標準誤差)
図1) IPSSトータルスコアの投与前後における変化量の推移 (第
相二重盲検比較臨床試験 (試験⑦) )
週
4 8 12
0 1 T
四 -1 - ー@- プラセボ
培
R -2 - ー@- タダラフィル 5mg
ロ
K づ - ※*※ : Dく0.01
避 前 まま※ : pく0.001
1 ] ※※玉
てう
を 。 つる]
ネネ
で] 玉素
ー7 - (最小二乗平均値 ょ 標準誤差)
図2) IPSSトータルスコアの投与前後における変化量の推移 (第想
相二重盲検比較了臨床試験 (試験③①) )
17.1.4 国内長期投与非盲検試験
第 相試験を完了した394例の被験者が42週の長期投与非盲検試験
に参加 した。 前立腺肥大症に伴う排尿障害患者にタダラフィル5mg
を1日1回54週間 (二重盲検期間12週を含む) 長期継続投与した結
果、IPSSトータルスコアの継続的な改善の維持が認められ、長期
の安全性及び良好な忍容性が確認きれため。
副作用発現頻度は、タダラフィル5mg群で10 .7% (42/394例) で
あった。主な加作用は、消化不良及び胃食道逆流性疾患が各1.3%
(5/394例) であった。
18. 薬効薬理
18.1 作用機序
タダラフィルはPDE5を阻害することにより、前立腺及び勝腕平滑
筋、並びに下部尿路血管の平滑筋内cGMP濃度を上昇させる。タダ
ラフィルによる血管拡張作用を介した血流増加が前立腺肥大症に
伴う排尿障害の症状緩和に寄与していると考えられる。また、前立
腺及び勝雄における平滑筋紀緩が血管に対する作用を補完してい
る可能性がある。
18.2 PDE5阻害作用
タダラフィルは選択的PDE5阻害剤である。ヒト遺伝子組み換え
PDE5を約1nMのICs値で阻害 し、PDE6及びPDE11と比較するとそ
れぞれ700及び14倍、その他のPDEサブタイプと比較すると9000倍
以上の選択性を示した9 (訪 婦みの)。
19. 有効成分に関する理化学的知見
一般的名称: タダラフィル (Tadalafil) [TAN]J
化学名 : (6Z,12aZ) -6- (1,3-benzodioxol-5-yl) -2-methyl-
2,3.6,7,12,12a-hexahydropyrazino [1,2:1.6] pyrido [3,4-ヵ]
indole-1 ,4-dione
分子式 : CgHnsNsO4
分子量 : 389.40
化学構造式 :
|
N
H ィ
H O
ie
性状 : 白色の粉末である。
ジメチルスルホキシドに溶けやすく、アセトニトリルにやや溶けに
くく、エタノール (99.5) に溶けにくく、水にほとんど溶けない。
分配係数 : 2.89 (1-オクタノール/水系)