よむ、つかう、まなぶ。
参考資料2:第2回合同会議までの委員の追加意見について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57354.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第10回 4/24)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
生命科学・医学系研究等における個人情報の取扱い等に関する合同会議
10
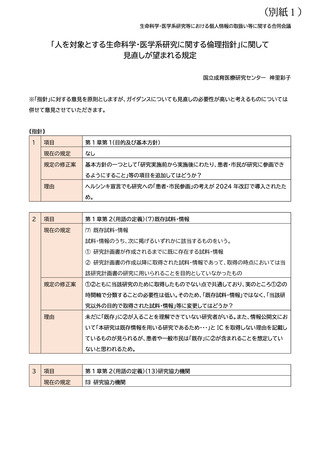
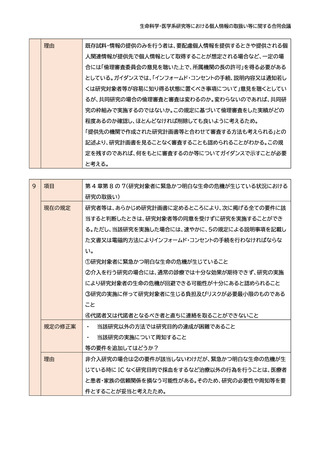
項目
第 15(重篤な有害事象への対応)
現在の規定
2 研究責任者の対応
⑶ 研究責任者は、侵襲を伴う研究の実施において重篤な有害事象の発生を知った場
合には、速やかに、当該有害事象や研究の継続等について倫理審査委員会に意見を聴
いた上で、その旨を研究機関の長に報告するとともに、⑴及び3の規定による手順書
等に従い、適切な対応を図らなければならない。また、速やかに当該研究の実施に携
わる研究者等に対して、当該有害事象の発生に係る情報を共有しなければならない。
規定の修正案
「~手順書等に従い、報告すべき重篤な有害事象の発生を知った場合には、~」等とし
てはどうか?
理由
(軽微を含む)侵襲を伴う研究で重篤な有害事象の発生を知った場合には、全例につい
て倫理審査委員会の意見を聴き、研究機関の長に報告することを求めているように読
める。しかし、指針は主に観察研究を対象としているところ、この対応は現実的には難
しいと考えたため。
《ガイダンス》
11
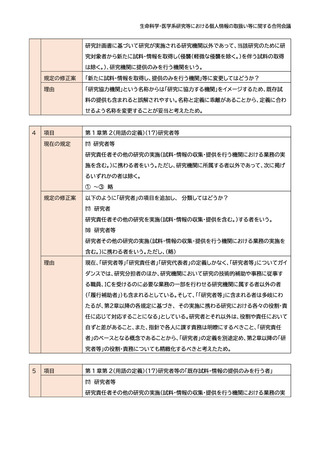
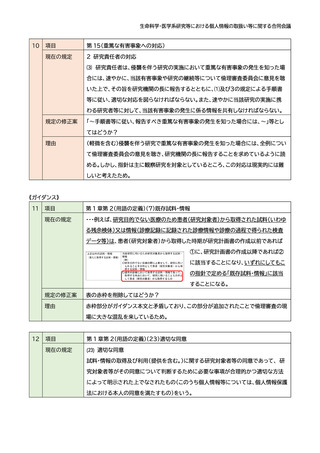
項目
第 1 章第 2(用語の定義)(7)既存試料・情報
現在の規定
・・・例えば、研究目的でない医療のため患者(研究対象者)から取得された試料(いわゆ
る残余検体)又は情報(診療記録に記録された診療情報や診療の過程で得られた検査
データ等)は、患者(研究対象者)から取得した時期が研究計画書の作成以前であれば
①に、研究計画書の作成以降であれば②
に該当することになり、いずれにしてもこ
の指針で定める「既存試料・情報」に該当
することになる。
規定の修正案
表の赤枠を削除してはどうか?
理由
赤枠部分がガイダンス本文と矛盾しており、この部分が追加されたことで倫理審査の現
場に大きな混乱を来しているため。
12
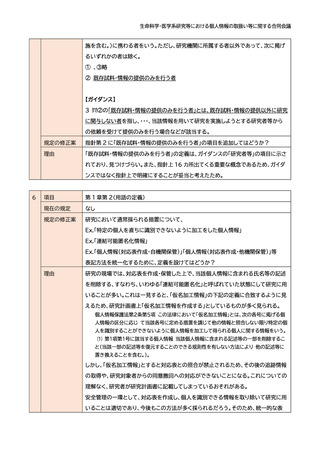
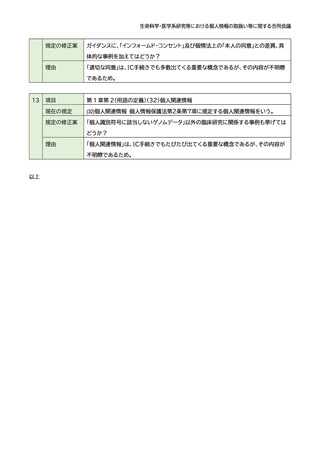
項目
第 1 章第 2(用語の定義)(23)適切な同意
現在の規定
(23) 適切な同意
試料・情報の取得及び利用(提供を含む。)に関する研究対象者等の同意であって、 研
究対象者等がその同意について判断するために必要な事項が合理的かつ適切な方法
によって明示された上でなされたもの(このうち個人情報等については、個人情報保護
法における本人の同意を満たすもの)をいう。
10
項目
第 15(重篤な有害事象への対応)
現在の規定
2 研究責任者の対応
⑶ 研究責任者は、侵襲を伴う研究の実施において重篤な有害事象の発生を知った場
合には、速やかに、当該有害事象や研究の継続等について倫理審査委員会に意見を聴
いた上で、その旨を研究機関の長に報告するとともに、⑴及び3の規定による手順書
等に従い、適切な対応を図らなければならない。また、速やかに当該研究の実施に携
わる研究者等に対して、当該有害事象の発生に係る情報を共有しなければならない。
規定の修正案
「~手順書等に従い、報告すべき重篤な有害事象の発生を知った場合には、~」等とし
てはどうか?
理由
(軽微を含む)侵襲を伴う研究で重篤な有害事象の発生を知った場合には、全例につい
て倫理審査委員会の意見を聴き、研究機関の長に報告することを求めているように読
める。しかし、指針は主に観察研究を対象としているところ、この対応は現実的には難
しいと考えたため。
《ガイダンス》
11
項目
第 1 章第 2(用語の定義)(7)既存試料・情報
現在の規定
・・・例えば、研究目的でない医療のため患者(研究対象者)から取得された試料(いわゆ
る残余検体)又は情報(診療記録に記録された診療情報や診療の過程で得られた検査
データ等)は、患者(研究対象者)から取得した時期が研究計画書の作成以前であれば
①に、研究計画書の作成以降であれば②
に該当することになり、いずれにしてもこ
の指針で定める「既存試料・情報」に該当
することになる。
規定の修正案
表の赤枠を削除してはどうか?
理由
赤枠部分がガイダンス本文と矛盾しており、この部分が追加されたことで倫理審査の現
場に大きな混乱を来しているため。
12
項目
第 1 章第 2(用語の定義)(23)適切な同意
現在の規定
(23) 適切な同意
試料・情報の取得及び利用(提供を含む。)に関する研究対象者等の同意であって、 研
究対象者等がその同意について判断するために必要な事項が合理的かつ適切な方法
によって明示された上でなされたもの(このうち個人情報等については、個人情報保護
法における本人の同意を満たすもの)をいう。