よむ、つかう、まなぶ。
【資料4】令和5年度欧米の薬事制度に関する調査・整理業務 調査結果 (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
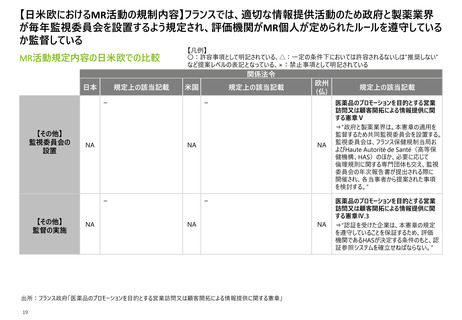
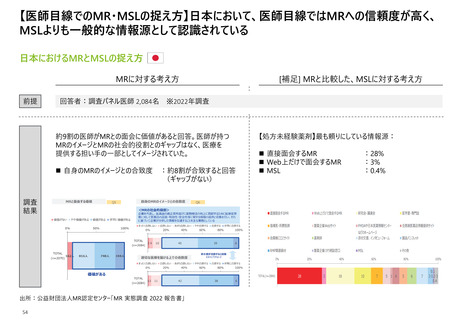
【日米欧におけるMR活動の規制内容】3極いずれも、MRが提供する情報は最新の状態に
更新することが義務付けられている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令
日本
規定上の該当記載
米国
医薬品、医療機器等の品質、
有効性及び安全性の確保等
に関する法律
景品表示法
及び関連する法規制
※P6-13参照
【提供情報】
最新ではない
情報の提供
×
×
規定上の該当記載
連邦規則集21編第301条(a)(b)
⇒FDA登録医薬品ついて情報の更新を
義務付けている。
FDA「Medical Product
Communications That Are
Consistent With the FDA-Required
Labeling Questions and Answers
Guidance for Industry」Ⅱ
⇒”企業は、FDAが要求する表示が虚偽ま
たは誤解を招くものでないことを確認するた
めに、必要に応じて情報を更新する義務が
ある。”
欧州
(仏)
規定上の該当記載
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅱ.1.(b)
⇒”企業は、プロモーション情報文書が
科学的、医学的、規制上の用語において
最新のものであることを保証する。”
×
出所:厚生労働省「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」「景品表示法」、アメリカ連邦政府「連邦規則集」、FDA「Medical Product
Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry Draft Guidance」、フランス政府「医薬品の
15 プロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」
更新することが義務付けられている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令
日本
規定上の該当記載
米国
医薬品、医療機器等の品質、
有効性及び安全性の確保等
に関する法律
景品表示法
及び関連する法規制
※P6-13参照
【提供情報】
最新ではない
情報の提供
×
×
規定上の該当記載
連邦規則集21編第301条(a)(b)
⇒FDA登録医薬品ついて情報の更新を
義務付けている。
FDA「Medical Product
Communications That Are
Consistent With the FDA-Required
Labeling Questions and Answers
Guidance for Industry」Ⅱ
⇒”企業は、FDAが要求する表示が虚偽ま
たは誤解を招くものでないことを確認するた
めに、必要に応じて情報を更新する義務が
ある。”
欧州
(仏)
規定上の該当記載
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅱ.1.(b)
⇒”企業は、プロモーション情報文書が
科学的、医学的、規制上の用語において
最新のものであることを保証する。”
×
出所:厚生労働省「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」「景品表示法」、アメリカ連邦政府「連邦規則集」、FDA「Medical Product
Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry Draft Guidance」、フランス政府「医薬品の
15 プロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」