よむ、つかう、まなぶ。
【資料4】令和5年度欧米の薬事制度に関する調査・整理業務 調査結果 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
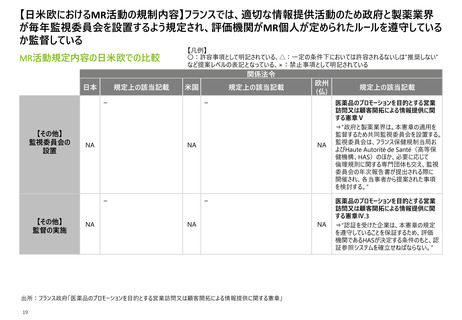
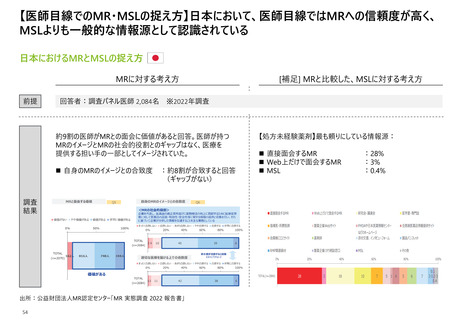
【日米欧におけるMR活動の規制内容】 3極いずれも、虚偽やミスリーディングな情報による医薬品の
プロモーションを禁止する規制があり、それを踏まえたガイドラインや業界団体による自主基準が作成
されている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令・ガイドライン
日本
規定上の該当記載
米国
規定上の該当記載
×
FDA「Medical Product
Communications That Are
Consistent With the FDA-Required
Labeling Questions and Answers
Guidance for Industry」Ⅲ.8
⇒企業の販促コミュニケーションをFDAが
要求するラベリングと一致させる方法
(中略):
• ”信頼できる研究結果またはその他の
データ/情報は、コミュニケーション上正確
に表現されるべきである。研究から提示
された情報(例:試験の種類や目的、
製品の用量/療法、対照、試験対象と
なった患者集団等)(中略)、研究
デザイン、方法論、及び結果に影響を
及ぼすその他制限についても明示され
るべきである。”
• ”自社にとり好ましくない、または一貫性
のない所見を開示することを含め、製品
に関する関連情報を正確に特徴づけ、
文脈化すべきである。”(次頁へ続く)
前頁同様
【提供情報】
誤解を招く曖昧な
広告/プロモーショ
ン活動
(2/3)
×
欧州
(仏)
×
規定上の該当記載
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅱ.1.(d)
⇒同じ治療目的を持つ競合の医薬品の
比較広告において、委員会が定めたルール
に準拠し、以下の広告基準を遵守しなけ
ればならない。
• “誤解を招く可能性がないこと”
• “比較対象となる医薬品は、同じ効能
を有し、同じ適応症に使用されること”
• “本質的、関連的、検証可能かつ、代
表的な特性を客観的に比較すること”
※競合他社の評判を不当に利用または
否定すること、広告主と競合他社等を
混同させること、ジェネリック医薬品等の
商標等を有する他の医薬品の模倣品とし
て自社の医薬品を不当に提示することは、
禁止されている。
出所:FDA「Medical Product Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry」、
フランス政府「医薬品のプロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」
13
プロモーションを禁止する規制があり、それを踏まえたガイドラインや業界団体による自主基準が作成
されている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令・ガイドライン
日本
規定上の該当記載
米国
規定上の該当記載
×
FDA「Medical Product
Communications That Are
Consistent With the FDA-Required
Labeling Questions and Answers
Guidance for Industry」Ⅲ.8
⇒企業の販促コミュニケーションをFDAが
要求するラベリングと一致させる方法
(中略):
• ”信頼できる研究結果またはその他の
データ/情報は、コミュニケーション上正確
に表現されるべきである。研究から提示
された情報(例:試験の種類や目的、
製品の用量/療法、対照、試験対象と
なった患者集団等)(中略)、研究
デザイン、方法論、及び結果に影響を
及ぼすその他制限についても明示され
るべきである。”
• ”自社にとり好ましくない、または一貫性
のない所見を開示することを含め、製品
に関する関連情報を正確に特徴づけ、
文脈化すべきである。”(次頁へ続く)
前頁同様
【提供情報】
誤解を招く曖昧な
広告/プロモーショ
ン活動
(2/3)
×
欧州
(仏)
×
規定上の該当記載
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅱ.1.(d)
⇒同じ治療目的を持つ競合の医薬品の
比較広告において、委員会が定めたルール
に準拠し、以下の広告基準を遵守しなけ
ればならない。
• “誤解を招く可能性がないこと”
• “比較対象となる医薬品は、同じ効能
を有し、同じ適応症に使用されること”
• “本質的、関連的、検証可能かつ、代
表的な特性を客観的に比較すること”
※競合他社の評判を不当に利用または
否定すること、広告主と競合他社等を
混同させること、ジェネリック医薬品等の
商標等を有する他の医薬品の模倣品とし
て自社の医薬品を不当に提示することは、
禁止されている。
出所:FDA「Medical Product Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry」、
フランス政府「医薬品のプロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」
13