よむ、つかう、まなぶ。
【資料4】令和5年度欧米の薬事制度に関する調査・整理業務 調査結果 (12 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_37109.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第14回 12/27)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
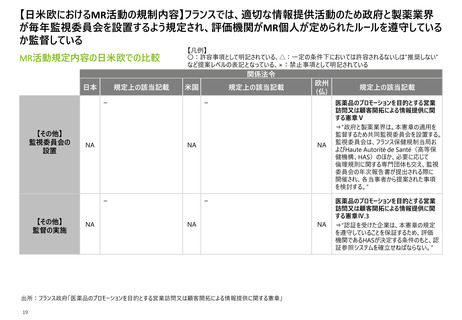
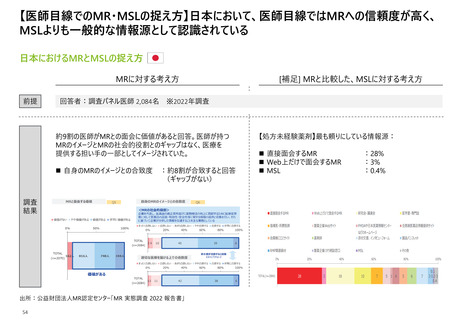
【日米欧におけるMR活動の規制内容】米欧では広告の事前提出を義務付けているが、
誤解を招く曖昧な広告/プロモーション活動は3極すべてで禁じられている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令
日本
規定上の該当記載
米国
ー
【提供情報】
広告の事前
未提出
【提供情報】
誤解を招く曖昧
な広告/プロモー
ション活動
(1/3)
×
NA
医薬品、医療機器等の品質、
有効性及び安全性の確保等
に関する法律
景品表示法
及び関連する法規制
※P6-13参照
×
規定上の該当記載
連邦規則集第21編第99条
⇒”医薬品又は医療機器の新たな用途の
安全性、有効性又は利益に関する情報は、
文書で広める60日前に、製造業者から
当局に提出しなければならない。”
欧州
(仏)
規定上の該当記載
×
公衆衛生法典L5122-9
⇒”医療従事者に対する医薬品の広告は、
「広告認可」として知られる国立医薬品・
医薬品安全庁からの事前の認可を条件と
する。(中略)遵守しない場合、承認は
緊急に一時停止されるか、または当局の理
由ある決定により撤回されることがある。”
×
公衆衛生法典L5122-2
⇒”広告は誤解を招いたり、公衆衛生の保
護を損なうものであってはならない。”
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅰ.2
⇒”医療専門家に対し、提示された医薬
品に関連する規制、薬物治療、医療経済
的側面に関するすべての情報を提供する
必要がある。”
同上Ⅰ.5
⇒”医療従事者向けの教育プログラムに
関する情報は、当該プログラムの医薬品に
関するいかなる販売促進情報とも切り離さ
なければならない。”
連邦規則集第21編第202条
⇒”副作用、禁忌および有効性に関する
正しい情報の記述は、広告全体に適用され
る要件である。”
×
FDA「Medical Product
Communications That Are Consistent
With the FDA-Required Labeling
Questions and Answers
Guidance for Industry」Ⅲ.6
⇒”企業が、情報をFDAが要求するラベリング
における販売促進情報に記載する場合は、
真実かつ誤解を招かない方法で記載しなけ
ればならない”
出所:厚生労働省「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」「景品表示法」、アメリカ連邦政府「連邦規則集」、Food and Drug
Administration(FDA)「Medical Product Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry」、
12 フランス政府「フランス公衆衛生法典」「医薬品のプロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」
誤解を招く曖昧な広告/プロモーション活動は3極すべてで禁じられている
MR活動規定内容の日米欧での比較
【凡例】
〇:許容事項として明記されている、△:一定の条件下においては許容されるないしは”推奨しない”
など提案レベルの表記となっている、×:禁止事項として明記されている
関係法令
日本
規定上の該当記載
米国
ー
【提供情報】
広告の事前
未提出
【提供情報】
誤解を招く曖昧
な広告/プロモー
ション活動
(1/3)
×
NA
医薬品、医療機器等の品質、
有効性及び安全性の確保等
に関する法律
景品表示法
及び関連する法規制
※P6-13参照
×
規定上の該当記載
連邦規則集第21編第99条
⇒”医薬品又は医療機器の新たな用途の
安全性、有効性又は利益に関する情報は、
文書で広める60日前に、製造業者から
当局に提出しなければならない。”
欧州
(仏)
規定上の該当記載
×
公衆衛生法典L5122-9
⇒”医療従事者に対する医薬品の広告は、
「広告認可」として知られる国立医薬品・
医薬品安全庁からの事前の認可を条件と
する。(中略)遵守しない場合、承認は
緊急に一時停止されるか、または当局の理
由ある決定により撤回されることがある。”
×
公衆衛生法典L5122-2
⇒”広告は誤解を招いたり、公衆衛生の保
護を損なうものであってはならない。”
医薬品のプロモーションを目的とする営業
訪問又は顧客開拓による情報提供に関
する憲章Ⅰ.2
⇒”医療専門家に対し、提示された医薬
品に関連する規制、薬物治療、医療経済
的側面に関するすべての情報を提供する
必要がある。”
同上Ⅰ.5
⇒”医療従事者向けの教育プログラムに
関する情報は、当該プログラムの医薬品に
関するいかなる販売促進情報とも切り離さ
なければならない。”
連邦規則集第21編第202条
⇒”副作用、禁忌および有効性に関する
正しい情報の記述は、広告全体に適用され
る要件である。”
×
FDA「Medical Product
Communications That Are Consistent
With the FDA-Required Labeling
Questions and Answers
Guidance for Industry」Ⅲ.6
⇒”企業が、情報をFDAが要求するラベリング
における販売促進情報に記載する場合は、
真実かつ誤解を招かない方法で記載しなけ
ればならない”
出所:厚生労働省「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」「景品表示法」、アメリカ連邦政府「連邦規則集」、Food and Drug
Administration(FDA)「Medical Product Communications That Are Consistent With the FDA-Required Labeling Questions and Answers Guidance for Industry」、
12 フランス政府「フランス公衆衛生法典」「医薬品のプロモーションを目的とする営業訪問又は顧客開拓による情報提供に関する憲章」