よむ、つかう、まなぶ。
資料1-3 ワクチンの安全性に関する評価について (78 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
<注意事項>
<注意事項>
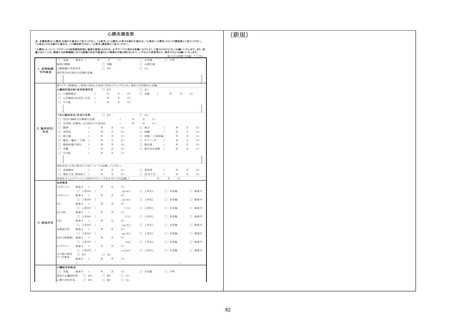
1~13.
1~13.
(略)
14. 独立行政法人医薬品医療機器総合機構ウェブサイト上にて
報告に係る記入要領を示しているため、報告にあたっては参照
してください。
15. 新型コロナワクチンについては、これまでワクチン接種と
の因果関係が示されていない症状も含め、幅広く評価を行って
いく必要があることから、当面の間、以下の症状については規
定による副反応疑い報告を積極的に検討するとともに、これら
以外の症状についても必要に応じて報告を検討してください。
けいれん、ギラン・バレ症候群、急性散在性脳脊髄炎
(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳
炎・脳症、脊髄炎、関節炎、顔面神経麻痺、血管迷走神経反射
(失神を伴うもの)
また、「血栓症(血栓塞栓症を含む。)(血小板減少症を伴
うものに限る。)」、心筋炎又は心膜炎について報告する場合
にあっては、別紙様式1記入要領別表の記載も踏まえ、別紙様
式1に加えて、血栓症(血栓塞栓症を含む。)(血小板減少症
を伴うものに限る。)(TTS)調査票、心筋炎調査票又は心
膜炎調査票をそれぞれ作成し、報告してください。ただし、心
筋炎及び心膜炎がともに疑われる場合には、心筋炎調査票及び
心膜炎調査票の両方を作成して報告してください。
なお、独立行政法人医薬品医療機器総合機構ウェブサイト上
にて新型コロナワクチンに係る報告の記載例を示しているた
め、報告にあたっては参照してください。
(略)
14. 独立行政法人医薬品医療機器総合機構ウェブサイト上にて
報告に係る記入要領を示しているため、報告にあたっては参照
すること。
15. 新型コロナワクチンについては、我が国において使用実績
がないワクチンであることを踏まえ、これまでワクチン接種と
の因果関係が示されていない症状も含め、幅広く評価を行って
いく必要があることから、当面の間、以下の症状については規
定による副反応疑い報告を積極的に検討するとともに、これ
ら以外の症状についても必要に応じて報告を検討すること。
けいれん、ギラン・バレ症候群、急性散在性脳脊髄炎
(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳
炎・脳症、脊髄炎、関節炎、心筋炎、顔面神経麻痺、血管迷走
神経反射(失神を伴うもの)
また、「血栓症(血栓塞栓症を含む。)(血小板減少症を伴
うものに限る。)」について報告する場合にあっては、別紙様
式1記入要領別表の記載も踏まえ、別紙様式1に加えて血栓症
(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)
(TTS)調査票を作成し、報告すること。
なお、独立行政法人医薬品医療機器総合機構ウェブサイト上
にて新型コロナワクチンに係る報告の記載例を示しているた
め、報告にあたっては参照すること。
78
<注意事項>
1~13.
1~13.
(略)
14. 独立行政法人医薬品医療機器総合機構ウェブサイト上にて
報告に係る記入要領を示しているため、報告にあたっては参照
してください。
15. 新型コロナワクチンについては、これまでワクチン接種と
の因果関係が示されていない症状も含め、幅広く評価を行って
いく必要があることから、当面の間、以下の症状については規
定による副反応疑い報告を積極的に検討するとともに、これら
以外の症状についても必要に応じて報告を検討してください。
けいれん、ギラン・バレ症候群、急性散在性脳脊髄炎
(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳
炎・脳症、脊髄炎、関節炎、顔面神経麻痺、血管迷走神経反射
(失神を伴うもの)
また、「血栓症(血栓塞栓症を含む。)(血小板減少症を伴
うものに限る。)」、心筋炎又は心膜炎について報告する場合
にあっては、別紙様式1記入要領別表の記載も踏まえ、別紙様
式1に加えて、血栓症(血栓塞栓症を含む。)(血小板減少症
を伴うものに限る。)(TTS)調査票、心筋炎調査票又は心
膜炎調査票をそれぞれ作成し、報告してください。ただし、心
筋炎及び心膜炎がともに疑われる場合には、心筋炎調査票及び
心膜炎調査票の両方を作成して報告してください。
なお、独立行政法人医薬品医療機器総合機構ウェブサイト上
にて新型コロナワクチンに係る報告の記載例を示しているた
め、報告にあたっては参照してください。
(略)
14. 独立行政法人医薬品医療機器総合機構ウェブサイト上にて
報告に係る記入要領を示しているため、報告にあたっては参照
すること。
15. 新型コロナワクチンについては、我が国において使用実績
がないワクチンであることを踏まえ、これまでワクチン接種と
の因果関係が示されていない症状も含め、幅広く評価を行って
いく必要があることから、当面の間、以下の症状については規
定による副反応疑い報告を積極的に検討するとともに、これ
ら以外の症状についても必要に応じて報告を検討すること。
けいれん、ギラン・バレ症候群、急性散在性脳脊髄炎
(ADEM)、血小板減少性紫斑病、血管炎、無菌性髄膜炎、脳
炎・脳症、脊髄炎、関節炎、心筋炎、顔面神経麻痺、血管迷走
神経反射(失神を伴うもの)
また、「血栓症(血栓塞栓症を含む。)(血小板減少症を伴
うものに限る。)」について報告する場合にあっては、別紙様
式1記入要領別表の記載も踏まえ、別紙様式1に加えて血栓症
(血栓塞栓症を含む。)(血小板減少症を伴うものに限る。)
(TTS)調査票を作成し、報告すること。
なお、独立行政法人医薬品医療機器総合機構ウェブサイト上
にて新型コロナワクチンに係る報告の記載例を示しているた
め、報告にあたっては参照すること。
78