よむ、つかう、まなぶ。
資料1-3 ワクチンの安全性に関する評価について (70 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24331.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会(令和3年度 第3回 3/11)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別紙
「定期の予防接種等による副反応疑いの報告等の取扱いについて」 新旧対照表
改
正 後
現
行
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
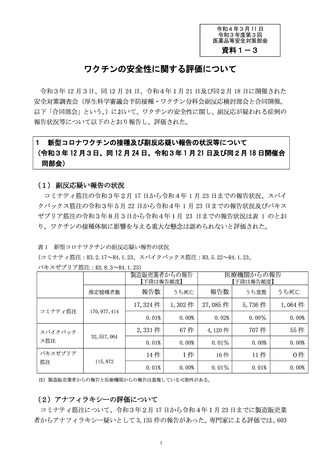
1 副反応疑い報告について
1 副反応疑い報告について
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ別
紙様式1並びに急性散在性脳脊髄炎(ADEM)調査票、
ギラン・バレ症候群(GBS)調査票及び血栓症(血栓塞
栓症を含む。)(血小板減少症を伴うものに限る。)(T
TS)調査票(以下「ADEM・GBS・TTS調査票」
という。)を管内の医療機関に配布し、医師等が予防接種
法施行規則(昭和 23 年厚生省令第 36 号)第5条に規定
する症状(別紙様式1の報告基準参照)を診断した場合に
は、速やかに機構へ FAX(FAX 番号:0120-176-146、新型
コロナウイルス感染症に係るワクチン(以下「新型コロナ
ワクチン」という。)予防接種に関するものについては、
専用 FAX 番号:0120-011-126)又は電子報告システム(報
告受付サイト URL:
https://www.pmda.go.jp/safety/reports/hcp/0002.html )にて報
告するよう周知すること。この報告は、患者に予防接種を
行った医師等以外の医師等も行うものとすること。FAX に
よる報告の場合、別紙様式1又は国立感染症研究所のホー
ムページからダウンロードできる予防接種後副反応疑い報
告書入力アプリにて作成した別紙様式2を使用して報告す
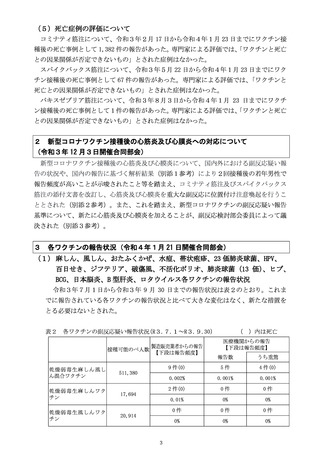
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ
別紙様式1並びに急性散在性脳脊髄炎(ADEM)調査
票、ギラン・バレ症候群(GBS)調査票、血栓症(血
栓塞栓症を含む。)(血小板減少症を伴うものに限
る。)(TTS)調査票、心筋炎調査票及び心膜炎調査
票(以下「全種調査票」という。)を管内の医療機関に
配布し、医師等が予防接種法施行規則(昭和 23 年厚生
省令第 36 号)第5条に規定する症状(別紙様式1の報
告基準参照)を診断した場合には、速やかに機構へ FAX
(FAX 番号:0120-176-146、新型コロナウイルス感染症
に係るワクチン(以下「新型コロナワクチン」とい
う。)予防接種に関するものについては、専用 FAX 番
号:0120-011-126)又は電子報告システム(報告受付サ
イト URL:
https://www.pmda.go.jp/safety/reports/hcp/0002.html )にて
報告するよう周知すること。この報告は、患者に予防接
種を行った医師等以外の医師等も行うものとすること。
FAX による報告の場合、別紙様式1又は国立感染症研究
所のホームページからダウンロードできる予防接種後副
70
「定期の予防接種等による副反応疑いの報告等の取扱いについて」 新旧対照表
改
正 後
現
行
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
定期の予防接種等による副反応疑いの報告等の取扱いについて
(略)
記
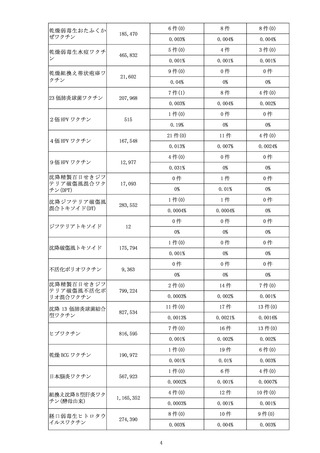
1 副反応疑い報告について
1 副反応疑い報告について
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ別
紙様式1並びに急性散在性脳脊髄炎(ADEM)調査票、
ギラン・バレ症候群(GBS)調査票及び血栓症(血栓塞
栓症を含む。)(血小板減少症を伴うものに限る。)(T
TS)調査票(以下「ADEM・GBS・TTS調査票」
という。)を管内の医療機関に配布し、医師等が予防接種
法施行規則(昭和 23 年厚生省令第 36 号)第5条に規定
する症状(別紙様式1の報告基準参照)を診断した場合に
は、速やかに機構へ FAX(FAX 番号:0120-176-146、新型
コロナウイルス感染症に係るワクチン(以下「新型コロナ
ワクチン」という。)予防接種に関するものについては、
専用 FAX 番号:0120-011-126)又は電子報告システム(報
告受付サイト URL:
https://www.pmda.go.jp/safety/reports/hcp/0002.html )にて報
告するよう周知すること。この報告は、患者に予防接種を
行った医師等以外の医師等も行うものとすること。FAX に
よる報告の場合、別紙様式1又は国立感染症研究所のホー
ムページからダウンロードできる予防接種後副反応疑い報
告書入力アプリにて作成した別紙様式2を使用して報告す
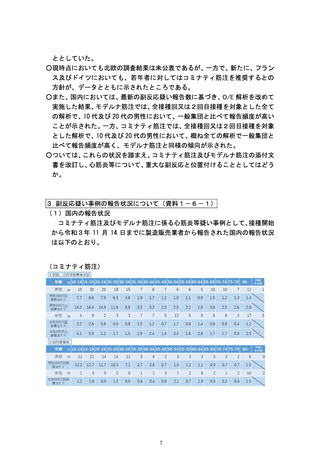
(1)市町村(特別区を含む。以下同じ。)は、あらかじめ
別紙様式1並びに急性散在性脳脊髄炎(ADEM)調査
票、ギラン・バレ症候群(GBS)調査票、血栓症(血
栓塞栓症を含む。)(血小板減少症を伴うものに限
る。)(TTS)調査票、心筋炎調査票及び心膜炎調査
票(以下「全種調査票」という。)を管内の医療機関に
配布し、医師等が予防接種法施行規則(昭和 23 年厚生
省令第 36 号)第5条に規定する症状(別紙様式1の報
告基準参照)を診断した場合には、速やかに機構へ FAX
(FAX 番号:0120-176-146、新型コロナウイルス感染症
に係るワクチン(以下「新型コロナワクチン」とい
う。)予防接種に関するものについては、専用 FAX 番
号:0120-011-126)又は電子報告システム(報告受付サ
イト URL:
https://www.pmda.go.jp/safety/reports/hcp/0002.html )にて
報告するよう周知すること。この報告は、患者に予防接
種を行った医師等以外の医師等も行うものとすること。
FAX による報告の場合、別紙様式1又は国立感染症研究
所のホームページからダウンロードできる予防接種後副
70