よむ、つかう、まなぶ。
08【参考資料2】新型コロナワクチンに関する資料 (74 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_31559.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第45回 3/7)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
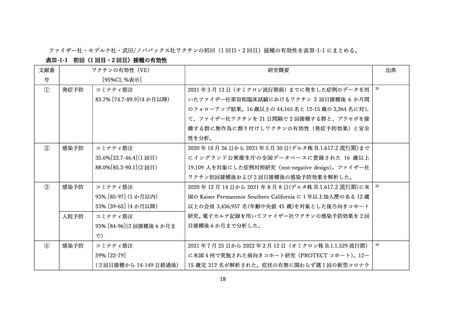
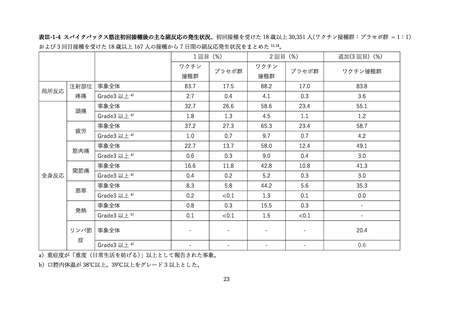
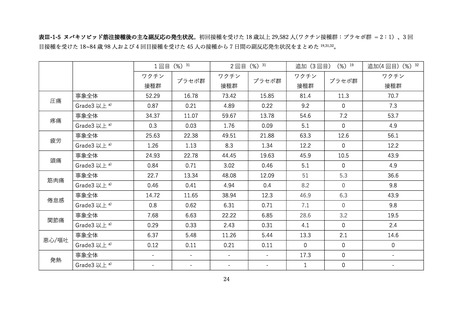
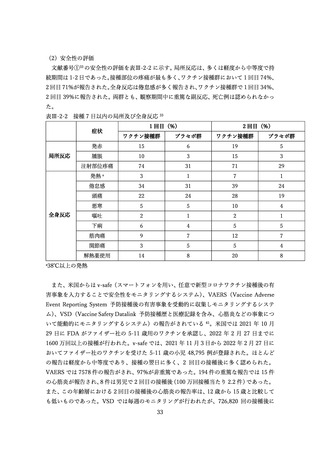
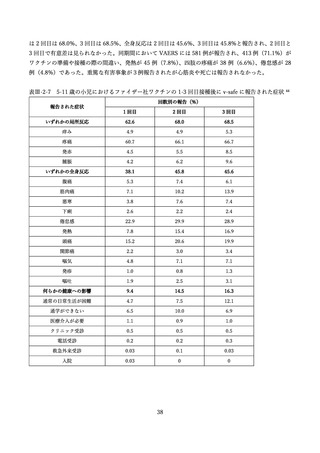
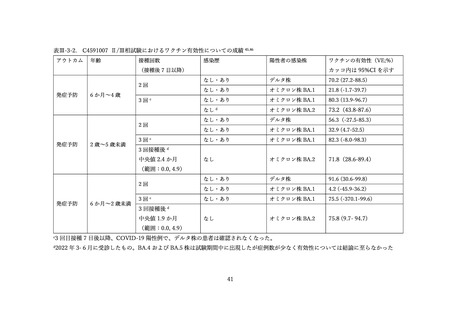
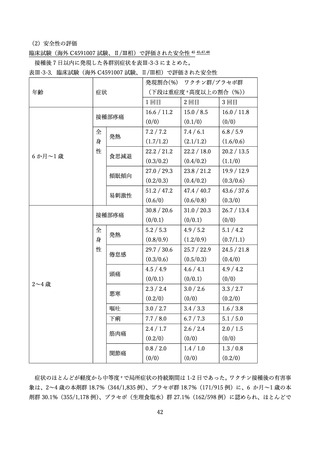
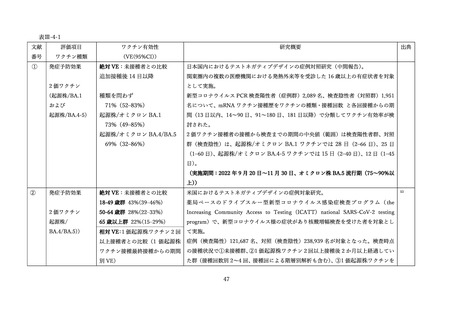
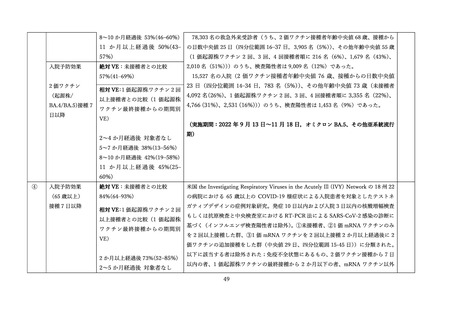
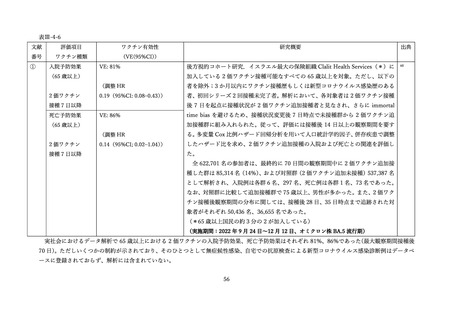
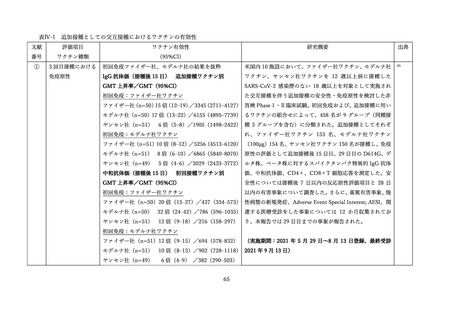
表 V-2 新型コロナワクチンとインフルエンザワクチンの同時接種における安全性
文献
副反応報告割合
研究概要
出典
番号
④
非同時接種群と比較して、同時接種群の新型コロナワクチン2回目接種
上記の表 VI-1 における文献①参照。
後7日間での全身副反応報告割合の差
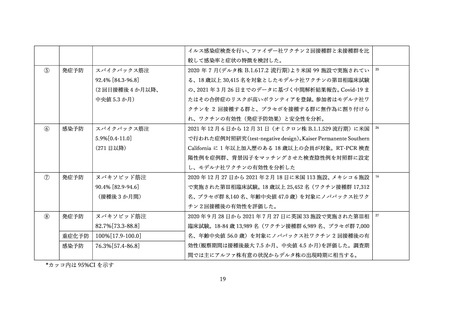
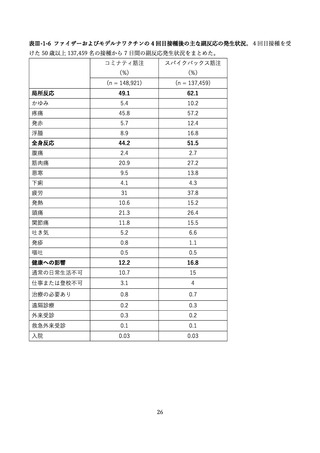
aTIV、QIVc、QIVr はいずれもインフルエンザ不活化ワクチン
で、aTIV は3価の MF59C アジュバントワクチン、QIVc・QIVr
4グループで非劣性(非劣性マージン 25%)が示された。
は細胞性またはリコンビナント4価ワクチンを指す。
アストラゼネカ社/QIVc:-1.29% [95%CI: -14.69-12.11]
ファイザー社/QIVc:6.17% [-6.27-18.61]
ファイザー社/aTIV:-12.9% [-34.15-8.37]
アストラゼネカ社/QIVr:2.53% [-13.25-18.31]
2グループで 95%CI の上限値が非劣性マージンを超えた。
アストラゼネカ社/aTIV: 10.3% [-5.44-26.03]
ファイザー社/QIVr:6.75% [-11.75-25.25]
観察期間を通じた全身副反応報告割合は非同時接種群と比較して、同時接
種群でも同程度であった。
74
65
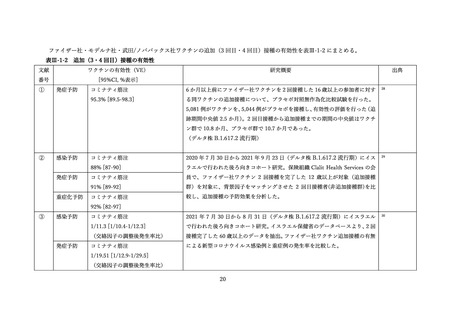
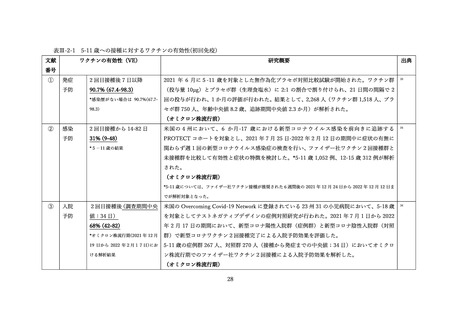
文献
副反応報告割合
研究概要
出典
番号
④
非同時接種群と比較して、同時接種群の新型コロナワクチン2回目接種
上記の表 VI-1 における文献①参照。
後7日間での全身副反応報告割合の差
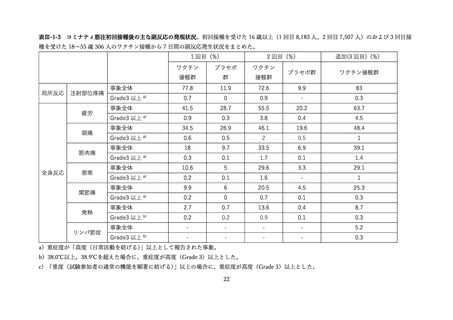
aTIV、QIVc、QIVr はいずれもインフルエンザ不活化ワクチン
で、aTIV は3価の MF59C アジュバントワクチン、QIVc・QIVr
4グループで非劣性(非劣性マージン 25%)が示された。
は細胞性またはリコンビナント4価ワクチンを指す。
アストラゼネカ社/QIVc:-1.29% [95%CI: -14.69-12.11]
ファイザー社/QIVc:6.17% [-6.27-18.61]
ファイザー社/aTIV:-12.9% [-34.15-8.37]
アストラゼネカ社/QIVr:2.53% [-13.25-18.31]
2グループで 95%CI の上限値が非劣性マージンを超えた。
アストラゼネカ社/aTIV: 10.3% [-5.44-26.03]
ファイザー社/QIVr:6.75% [-11.75-25.25]
観察期間を通じた全身副反応報告割合は非同時接種群と比較して、同時接
種群でも同程度であった。
74
65