よむ、つかう、まなぶ。
参考資料4 新型コロナワクチン「コミナティ筋注6ヵ月~4歳用」(ファイザー株式会社)審査報告書 (23 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
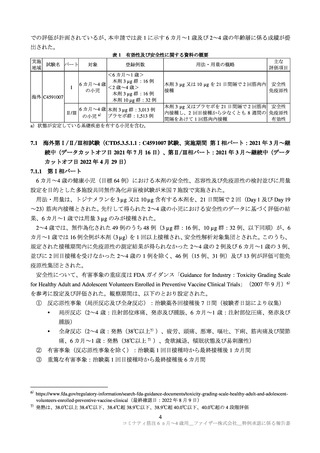
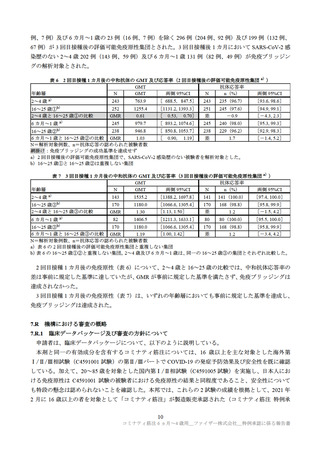
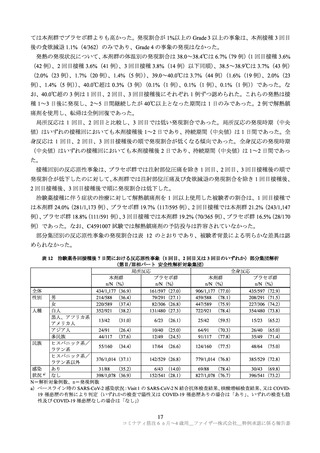
第Ⅱ/Ⅲ相パートで認められたデータカットオフ日(2022 年 4 月 29 日)までの重篤な有害事象は、本
剤群で 0.7%(12/1,835 例)
、プラセボ群で 0.9%(8/915 例)であった(7.1.2 参照)。また、いずれのパー
トでも死亡例は認められなかった。
特に注目すべき有害事象として、自己免疫性又は神経炎症性の事象、ワクチン接種と理論的に関連す
る事象、COVID-19 発症例で発現することが想定される事象が評価された。いずれのパートにおいても、
心筋炎、心膜炎、ベル麻痺(又は顔面麻痺/顔面不全麻痺)、アナフィラキシーは認められなかった。第
Ⅱ/Ⅲ相パートの本剤群においてリンパ節症 1 例及び虫垂炎 2 例報告され、リンパ節症の 1 例について
は本剤接種との因果関係が否定されなかったが、転帰は回復であった。
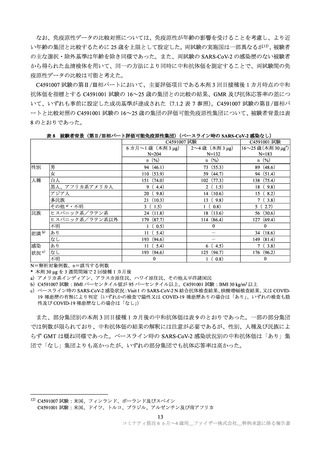
6 カ月~1 歳
第Ⅰ相パート(データカットオフ日:2021 年 7 月 16 日)では重篤な有害事象は認められなかった。
第Ⅱ/Ⅲ相パートで認められたデータカットオフ日(2022 年 4 月 29 日)までの重篤な有害事象は、本
剤群で 1.4%(17/1,178 例)
、プラセボ群で 2.3%(14/598 例)であった(7.1.2 参照)。また、いずれのパ
ートでも死亡例は認められなかった。
特に注目すべき有害事象について、2~4 歳の集団と同様の評価が行われたが、いずれのパートにおい
ても、心筋炎、心膜炎、ベル麻痺(又は顔面麻痺/顔面不全麻痺)
、虫垂炎、アナフィラキシーは認め
られなかった。第Ⅱ/Ⅲ相パートの本剤群において 2 例のリンパ節症が報告され、リンパ節症の 1 例に
ついては本剤接種との因果関係が否定されなかったが、この 1 例の転帰は回復であった。
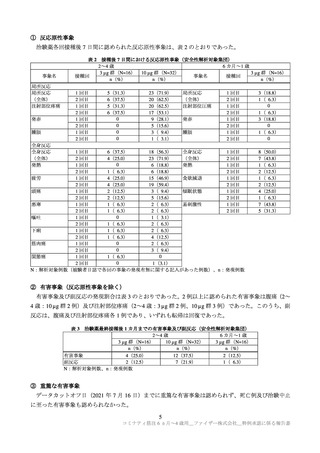
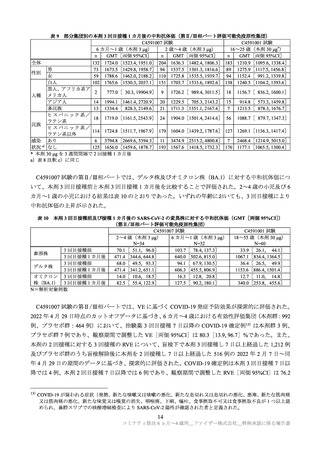
以上の①~③で示したとおり、C4591007 試験の 6 か月~4 歳の集団において、本剤を接種された被験
者の多くで反応原性事象(局所反応及び全身反応)が認められたが、ほとんどは軽度又は中等度であり、
症状発現後短時間で消失しており、
これまでに 5 歳以上で確認されているプロファイルと同様であった。
また、反応原性事象以外の有害事象の発現割合は低くほとんどは軽度又は中等度であり、重篤な有害事
象及び治験中止に至った有害事象の発現割合も低かったこと、注目すべき有害事象は少数例に認められ
たが本剤との関連が疑われるアナフィラキシーや心筋炎、心膜炎は認められなかったこと等から、現時
点で 6 カ月~4 歳の小児における本剤の安全性に重大な懸念は認められておらず、忍容性は確認された
と考える。
機構は、以下のように考える。
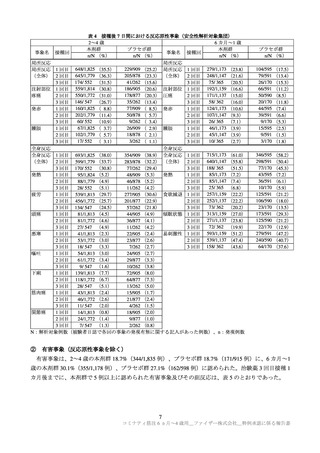
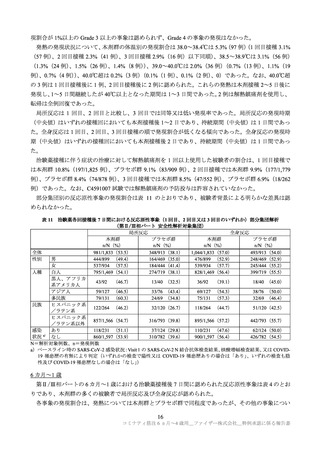
C4591007 試験の被験者の多くに認められた反応原性事象(局所反応及び全身反応)のほとんどは軽度
又は中等度であり回復性が認められている。また、反応原性事象以外の有害事象の発現割合は低く、ほ
とんどは軽度又は中等度であること等を確認し、現時点で得られている情報からは、6 カ月~4 歳の小児
における本剤の安全性に重大な懸念は認められていないと判断した。
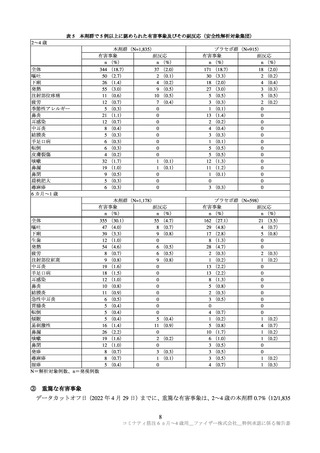
ただし、6 カ月~4 歳の小児における安全性情報は限られていること等から、製造販売後には当該年齢
層の小児における本剤の安全性情報を収集し、得られた情報に基づき適時適切に安全対策措置の内容を
見直す必要がある。また、局所反応や全身反応が多くの被験者に認められることに加え、発現割合の高
い事象の発現時期や持続期間等については、医療従事者、被接種者やその保護者等に対して適切に情報
提供する必要がある。
19
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書
剤群で 0.7%(12/1,835 例)
、プラセボ群で 0.9%(8/915 例)であった(7.1.2 参照)。また、いずれのパー
トでも死亡例は認められなかった。
特に注目すべき有害事象として、自己免疫性又は神経炎症性の事象、ワクチン接種と理論的に関連す
る事象、COVID-19 発症例で発現することが想定される事象が評価された。いずれのパートにおいても、
心筋炎、心膜炎、ベル麻痺(又は顔面麻痺/顔面不全麻痺)、アナフィラキシーは認められなかった。第
Ⅱ/Ⅲ相パートの本剤群においてリンパ節症 1 例及び虫垂炎 2 例報告され、リンパ節症の 1 例について
は本剤接種との因果関係が否定されなかったが、転帰は回復であった。
6 カ月~1 歳
第Ⅰ相パート(データカットオフ日:2021 年 7 月 16 日)では重篤な有害事象は認められなかった。
第Ⅱ/Ⅲ相パートで認められたデータカットオフ日(2022 年 4 月 29 日)までの重篤な有害事象は、本
剤群で 1.4%(17/1,178 例)
、プラセボ群で 2.3%(14/598 例)であった(7.1.2 参照)。また、いずれのパ
ートでも死亡例は認められなかった。
特に注目すべき有害事象について、2~4 歳の集団と同様の評価が行われたが、いずれのパートにおい
ても、心筋炎、心膜炎、ベル麻痺(又は顔面麻痺/顔面不全麻痺)
、虫垂炎、アナフィラキシーは認め
られなかった。第Ⅱ/Ⅲ相パートの本剤群において 2 例のリンパ節症が報告され、リンパ節症の 1 例に
ついては本剤接種との因果関係が否定されなかったが、この 1 例の転帰は回復であった。
以上の①~③で示したとおり、C4591007 試験の 6 か月~4 歳の集団において、本剤を接種された被験
者の多くで反応原性事象(局所反応及び全身反応)が認められたが、ほとんどは軽度又は中等度であり、
症状発現後短時間で消失しており、
これまでに 5 歳以上で確認されているプロファイルと同様であった。
また、反応原性事象以外の有害事象の発現割合は低くほとんどは軽度又は中等度であり、重篤な有害事
象及び治験中止に至った有害事象の発現割合も低かったこと、注目すべき有害事象は少数例に認められ
たが本剤との関連が疑われるアナフィラキシーや心筋炎、心膜炎は認められなかったこと等から、現時
点で 6 カ月~4 歳の小児における本剤の安全性に重大な懸念は認められておらず、忍容性は確認された
と考える。
機構は、以下のように考える。
C4591007 試験の被験者の多くに認められた反応原性事象(局所反応及び全身反応)のほとんどは軽度
又は中等度であり回復性が認められている。また、反応原性事象以外の有害事象の発現割合は低く、ほ
とんどは軽度又は中等度であること等を確認し、現時点で得られている情報からは、6 カ月~4 歳の小児
における本剤の安全性に重大な懸念は認められていないと判断した。
ただし、6 カ月~4 歳の小児における安全性情報は限られていること等から、製造販売後には当該年齢
層の小児における本剤の安全性情報を収集し、得られた情報に基づき適時適切に安全対策措置の内容を
見直す必要がある。また、局所反応や全身反応が多くの被験者に認められることに加え、発現割合の高
い事象の発現時期や持続期間等については、医療従事者、被接種者やその保護者等に対して適切に情報
提供する必要がある。
19
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書