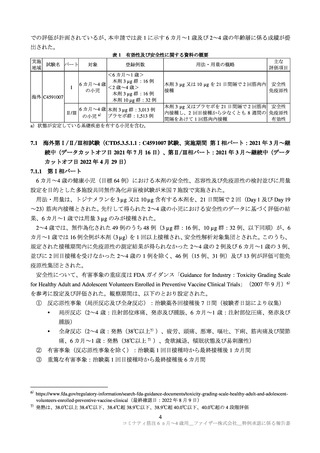
よむ、つかう、まなぶ。
参考資料4 新型コロナワクチン「コミナティ筋注6ヵ月~4歳用」(ファイザー株式会社)審査報告書 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
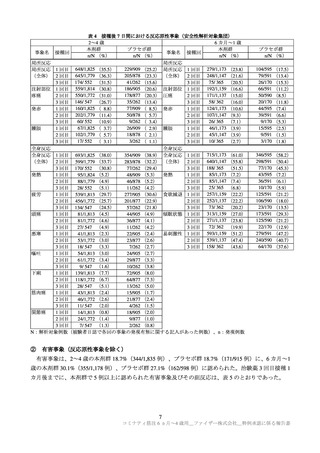
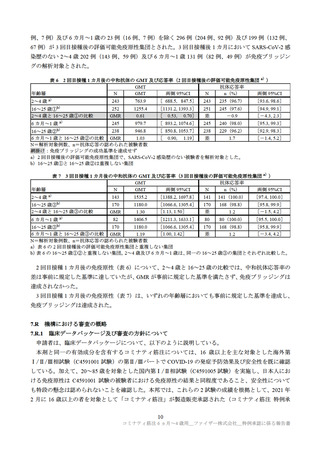
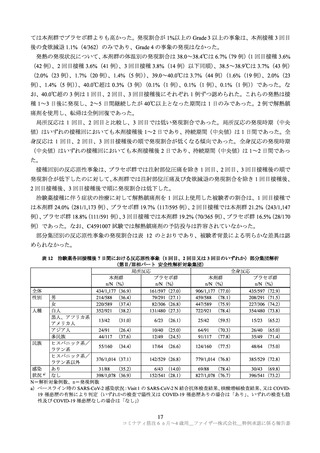
表 4 接種後 7 日間における反応原性事象(安全性解析対象集団)
2~4 歳
6 カ月~1 歳
本剤群
プラセボ群
本剤群
事象名 接種回
事象名 接種回
n/N (%)
n/N (%)
n/N (%)
局所反応
局所反応
229/909 (25.2) 局所反応 1 回目 279/1,173 (23.8)
局所反応 1 回目 648/1,825 (35.5)
645/1,779
205/878 (23.3) (全体) 2 回目 248/1,147 (21.6)
(全体) 2 回目
(36.3)
174/
552
41/262 (15.6)
75/ 365 (20.5)
3 回目
(31.5)
3 回目
186/905 (20.6) 注射部位 1 回目 192/1,159 (16.6)
注射部位 1 回目 559/1,814 (30.8)
178/877 (20.3) 圧痛
疼痛
2 回目 550/1,772 (31.0)
2 回目 171/1,137 (15.0)
35/262 (13.4)
58/ 362 (16.0)
3 回目 146/ 547 (26.7)
3 回目
77/909 ( 8.5) 発赤
発赤
1 回目 160/1,825 ( 8.8)
1 回目 124/1,173 (10.6)
50/878 ( 5.7)
2 回目 202/1,779 (11.4)
2 回目 107/1,147 (9.3)
60/ 552 (10.9)
9/262 ( 3.4)
26/ 365 (7.1)
3 回目
3 回目
67/1,825 ( 3.7)
26/909 ( 2.9) 腫脹
46/1,173 (3.9)
腫脹
1 回目
1 回目
18/878 ( 2.1)
45/1,147 (3.9)
2 回目 102/1,779 ( 5.7)
2 回目
17/ 552 ( 3.1)
3/262 ( 1.1)
10/ 365 (2.7)
3 回目
3 回目
全身反応
全身反応
全身反応 1 回目 693/1,825 (38.0)
354/909 (38.9) 全身反応 1 回目 715/1,173 (61.0)
(全体) 2 回目 599/1,779 (33.7)
283/878 (32.2) (全体) 2 回目 640/1,147 (55.8)
3 回目 170/ 552 (30.8)
77/262 (29.4)
3 回目 188/ 365 (51.5)
85/1,173 (7.2)
発熱
1 回目
(5.2)
(5.3)
発熱
1 回目
95/1,824
48/909
85/1,147 (7.4)
2 回目
88/1,779 (4.9)
46/878 (5.2)
2 回目
25/
365 (6.8)
3 回目
3 回目
28/ 552 (5.1)
11/262 (4.2)
257/1,159
疲労
1 回目 539/1,813 (29.7)
(22.2)
277/905 (30.6) 食欲減退 1 回目
2 回目 456/1,772 (25.7)
201/877 (22.9)
2 回目 252/1,137 (22.2)
73/ 362 (20.2)
3 回目 134/ 547 (24.5)
3 回目
57/262 (21.8)
頭痛
1 回目
81/1,813 (4.5)
44/905 (4.9) 傾眠状態 1 回目 313/1,159 (27.0)
2 回目
2 回目 271/1,137 (23.8)
81/1,772 (4.6)
36/877 (4.1)
72/ 362 (19.9)
3 回目
27/ 547 (4.9)
11/262 (4.2)
3 回目
悪寒
1 回目
41/1,813 (2.3)
22/905 (2.4) 易刺激性 1 回目 593/1,159 (51.2)
2 回目
2 回目 539/1,137 (47.4)
53/1,772 (3.0)
23/877 (2.6)
3 回目
18/ 547 (3.3)
7/262 (2.7)
3 回目 158/ 362 (43.6)
嘔吐
1 回目
54/1,813 (3.0)
24/905 (2.7)
2 回目
61/1,772 (3.4)
29/877 (3.3)
3 回目
9/ 547 (1.6)
10/262 (3.8)
下痢
1 回目 139/1,813 (7.7)
72/905 (8.0)
2 回目 118/1,772 (6.7)
64/877 (7.3)
3 回目
28/ 547 (5.1)
13/262 (5.0)
筋肉痛
1 回目
43/1,813 (2.4)
15/905 (1.7)
2 回目
46/1,772 (2.6)
21/877 (2.4)
3 回目
11/ 547 (2.0)
4/262 (1.5)
関節痛
1 回目
14/1,813 (0.8)
18/905 (2.0)
2 回目
24/1,772 (1.4)
9/877 (1.0)
3 回目
7/ 547 (1.3)
2/262 (0.8)
N:解析対象例数(被験者日誌で各回の事象の発現有無に関する記入があった例数)、n:発現例数
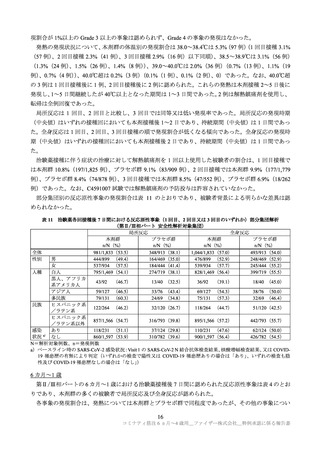
プラセボ群
n/N (%)
104/595
79/591
26/170
66/591
50/590
20/170
44/595
39/591
9/170
15/595
9/591
3/170
(17.5)
(13.4)
(15.3)
(11.2)
(8.5)
(11.8)
(7.4)
(6.6)
(5.3)
(2.5)
(1.5)
(1.8)
346/595
298/591
77/170
43/595
36/591
10/170
125/591
106/590
23/170
173/591
125/590
22/170
279/591
240/590
64/170
(58.2)
(50.4)
(45.3)
(7.2)
(6.1)
(5.9)
(21.2)
(18.0)
(13.5)
(29.3)
(21.2)
(12.9)
(47.2)
(40.7)
(37.6)
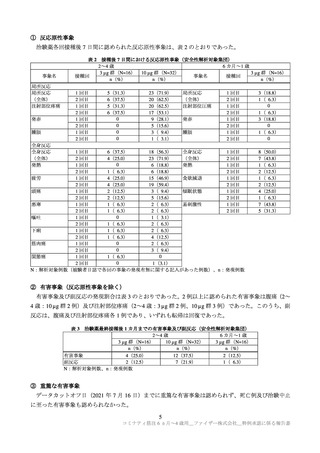
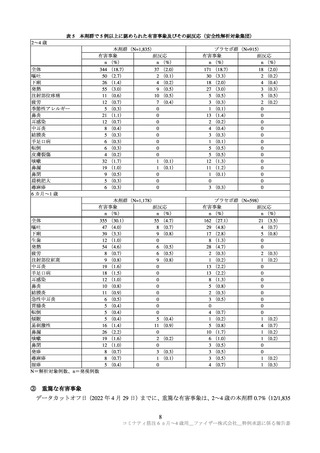
② 有害事象(反応原性事象を除く)
有害事象は、2~4 歳の本剤群 18.7%(344/1,835 例)、プラセボ群 18.7%(171/915 例)に、6 カ月~1
歳の本剤群 30.1%(355/1,178 例)、プラセボ群 27.1%(162/598 例)に認められた。治験薬 3 回目接種 1
カ月後までに、本剤群で 5 例以上に認められた有害事象及びその副反応は、表 5 のとおりであった。
7
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書
2~4 歳
6 カ月~1 歳
本剤群
プラセボ群
本剤群
事象名 接種回
事象名 接種回
n/N (%)
n/N (%)
n/N (%)
局所反応
局所反応
229/909 (25.2) 局所反応 1 回目 279/1,173 (23.8)
局所反応 1 回目 648/1,825 (35.5)
645/1,779
205/878 (23.3) (全体) 2 回目 248/1,147 (21.6)
(全体) 2 回目
(36.3)
174/
552
41/262 (15.6)
75/ 365 (20.5)
3 回目
(31.5)
3 回目
186/905 (20.6) 注射部位 1 回目 192/1,159 (16.6)
注射部位 1 回目 559/1,814 (30.8)
178/877 (20.3) 圧痛
疼痛
2 回目 550/1,772 (31.0)
2 回目 171/1,137 (15.0)
35/262 (13.4)
58/ 362 (16.0)
3 回目 146/ 547 (26.7)
3 回目
77/909 ( 8.5) 発赤
発赤
1 回目 160/1,825 ( 8.8)
1 回目 124/1,173 (10.6)
50/878 ( 5.7)
2 回目 202/1,779 (11.4)
2 回目 107/1,147 (9.3)
60/ 552 (10.9)
9/262 ( 3.4)
26/ 365 (7.1)
3 回目
3 回目
67/1,825 ( 3.7)
26/909 ( 2.9) 腫脹
46/1,173 (3.9)
腫脹
1 回目
1 回目
18/878 ( 2.1)
45/1,147 (3.9)
2 回目 102/1,779 ( 5.7)
2 回目
17/ 552 ( 3.1)
3/262 ( 1.1)
10/ 365 (2.7)
3 回目
3 回目
全身反応
全身反応
全身反応 1 回目 693/1,825 (38.0)
354/909 (38.9) 全身反応 1 回目 715/1,173 (61.0)
(全体) 2 回目 599/1,779 (33.7)
283/878 (32.2) (全体) 2 回目 640/1,147 (55.8)
3 回目 170/ 552 (30.8)
77/262 (29.4)
3 回目 188/ 365 (51.5)
85/1,173 (7.2)
発熱
1 回目
(5.2)
(5.3)
発熱
1 回目
95/1,824
48/909
85/1,147 (7.4)
2 回目
88/1,779 (4.9)
46/878 (5.2)
2 回目
25/
365 (6.8)
3 回目
3 回目
28/ 552 (5.1)
11/262 (4.2)
257/1,159
疲労
1 回目 539/1,813 (29.7)
(22.2)
277/905 (30.6) 食欲減退 1 回目
2 回目 456/1,772 (25.7)
201/877 (22.9)
2 回目 252/1,137 (22.2)
73/ 362 (20.2)
3 回目 134/ 547 (24.5)
3 回目
57/262 (21.8)
頭痛
1 回目
81/1,813 (4.5)
44/905 (4.9) 傾眠状態 1 回目 313/1,159 (27.0)
2 回目
2 回目 271/1,137 (23.8)
81/1,772 (4.6)
36/877 (4.1)
72/ 362 (19.9)
3 回目
27/ 547 (4.9)
11/262 (4.2)
3 回目
悪寒
1 回目
41/1,813 (2.3)
22/905 (2.4) 易刺激性 1 回目 593/1,159 (51.2)
2 回目
2 回目 539/1,137 (47.4)
53/1,772 (3.0)
23/877 (2.6)
3 回目
18/ 547 (3.3)
7/262 (2.7)
3 回目 158/ 362 (43.6)
嘔吐
1 回目
54/1,813 (3.0)
24/905 (2.7)
2 回目
61/1,772 (3.4)
29/877 (3.3)
3 回目
9/ 547 (1.6)
10/262 (3.8)
下痢
1 回目 139/1,813 (7.7)
72/905 (8.0)
2 回目 118/1,772 (6.7)
64/877 (7.3)
3 回目
28/ 547 (5.1)
13/262 (5.0)
筋肉痛
1 回目
43/1,813 (2.4)
15/905 (1.7)
2 回目
46/1,772 (2.6)
21/877 (2.4)
3 回目
11/ 547 (2.0)
4/262 (1.5)
関節痛
1 回目
14/1,813 (0.8)
18/905 (2.0)
2 回目
24/1,772 (1.4)
9/877 (1.0)
3 回目
7/ 547 (1.3)
2/262 (0.8)
N:解析対象例数(被験者日誌で各回の事象の発現有無に関する記入があった例数)、n:発現例数
プラセボ群
n/N (%)
104/595
79/591
26/170
66/591
50/590
20/170
44/595
39/591
9/170
15/595
9/591
3/170
(17.5)
(13.4)
(15.3)
(11.2)
(8.5)
(11.8)
(7.4)
(6.6)
(5.3)
(2.5)
(1.5)
(1.8)
346/595
298/591
77/170
43/595
36/591
10/170
125/591
106/590
23/170
173/591
125/590
22/170
279/591
240/590
64/170
(58.2)
(50.4)
(45.3)
(7.2)
(6.1)
(5.9)
(21.2)
(18.0)
(13.5)
(29.3)
(21.2)
(12.9)
(47.2)
(40.7)
(37.6)
② 有害事象(反応原性事象を除く)
有害事象は、2~4 歳の本剤群 18.7%(344/1,835 例)、プラセボ群 18.7%(171/915 例)に、6 カ月~1
歳の本剤群 30.1%(355/1,178 例)、プラセボ群 27.1%(162/598 例)に認められた。治験薬 3 回目接種 1
カ月後までに、本剤群で 5 例以上に認められた有害事象及びその副反応は、表 5 のとおりであった。
7
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書