よむ、つかう、まなぶ。
参考資料4 新型コロナワクチン「コミナティ筋注6ヵ月~4歳用」(ファイザー株式会社)審査報告書 (13 ページ)
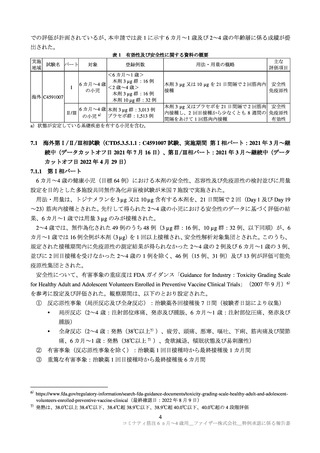
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000208910_00053.html |
| 出典情報 | 第87回厚生科学審議会予防接種・ワクチン分科会副反応検討部会、令和4年度第16回薬事・食品衛生審議会薬事分科会医薬品等安全対策部会安全対策調査会(合同開催)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
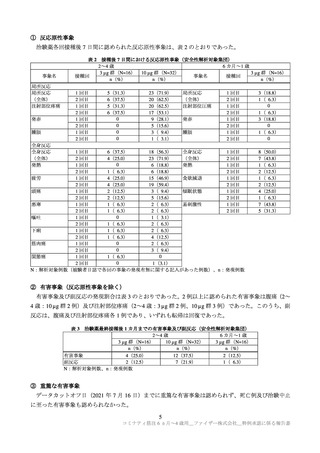
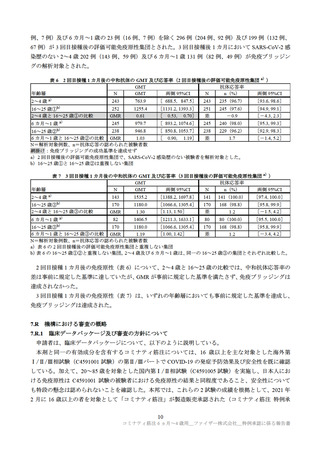
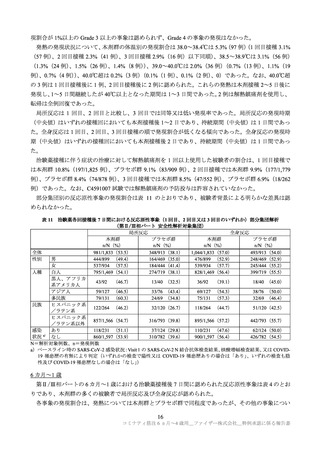
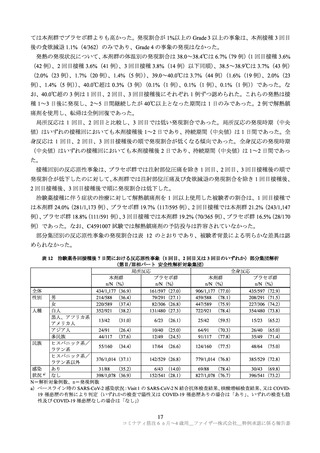
例)、プラセボ群 0.9%(8/915 例)に、6 カ月~1 歳の本剤群 1.4%(17/1,178 例)、プラセボ群 2.3%(14/598
例)に認められた。各年齢層で認められた重篤な有害事象は以下のとおりであった(重複症例あり)。
2~4 歳
本剤群:虫垂炎及び脱水各 2 例、下痢、発熱、限局性腹膜炎、ロタウイルス性胃腸炎、ウイルス性胃
腸炎、下気道感染、上気道感染、四肢痛、てんかん、熱性痙攣及びてんかん重積状態各 1 例
プラセボ群:視神経乳頭浮腫、胃腸炎、アデノウイルス性胃腸炎、ロタウイルス胃腸炎、体内異物、
てんかん、熱性痙攣及び気管支反応性亢進各 1 例
6 カ月~1 歳
本剤群:RS ウイルス細気管支炎 4 例、胃腸炎及び肺炎各 2 例、アナフィラキシー反応、肛門膿瘍、エ
ンテロウイルス感染、ロタウイルス胃腸炎、ウイルス性胃腸炎、大腸感染、下気道感染、ウ
イルス性下気道感染、メタニューモウイルス感染、RS ウイルス感染、ライノウイルス感染、
偶発的過量投与、熱性痙攣及び痙攣発作各 1 例
プラセボ群:細気管支炎及びチアノーゼ各 2 例、嘔吐、アナフィラキシー反応、ノロウイルス性胃腸
炎、ロタウイルス胃腸炎、RS ウイルス細気管支炎、扁桃炎、ウイルス感染、第 2 度熱傷、頭
部損傷、熱傷、栄養補給不耐性、低血糖、気縦隔症及び呼吸窮迫各 1 例
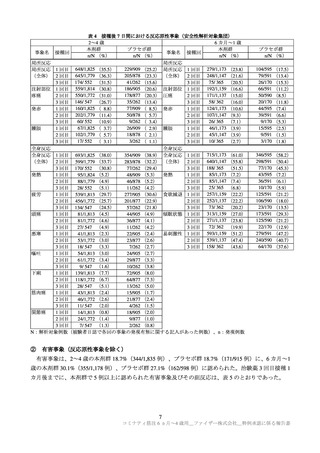
2~4 歳の本剤群の発熱及び四肢痛、6 カ月~1 歳のプラセボ群のチアノーゼを除き、治験薬との因果
関係は否定され、転帰は軽快又は回復であった。
治験中止に至った有害事象は、2~4 歳の本剤群 3 例(発熱、てんかん重積状態及び蕁麻疹各 1 例)、
プラセボ群 1 例(顔面腫脹及び斑状皮疹)に、6 カ月~1 歳の本剤群 2 例(発熱 2 例及び発疹 1 例(重複
症例あり))に認められ、てんかん重積状態を除き本剤との因果関係はありとされ、いずれも転帰は回
復であった。
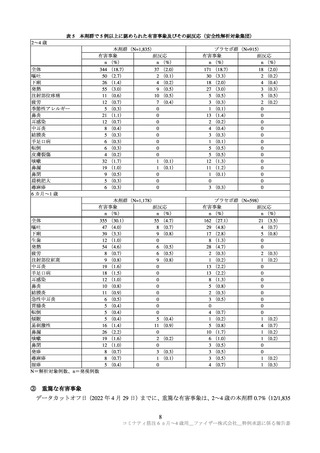
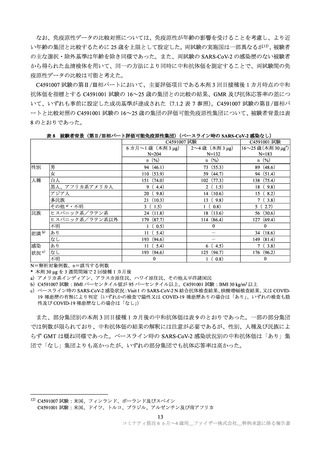
免疫原性については、GMR と中和抗体応答率を評価指標とし、以下の判定基準により C4591007 試験
と C4591001 試験の成績を比較して、免疫ブリッジングの成否が評価された。
GMR:GMR の両側 95%信頼区間の下限が 0.67 を上回り、かつ GMR の点推定値が 0.8 以上(治験
実施計画書の規定)又は 1 以上(FDA の定義)であった場合に GMR に基づく免疫ブリッジング成
功とした。
中和抗体応答率:ベースライン(1 回目接種前)から SARS-CoV-2 中和抗体価が 4 倍以上に上昇し
た被験者の割合を抗体応答率と定義し、ベースライン値が定量下限値(LLOQ)未満の場合は、ワク
チン接種後の値が LLOQ の 4 倍以上のときに抗体応答とした。GMR に基づく免疫ブリッジングが
達成された条件の下で、中和抗体応答率の差の両側 95%信頼区間の下限が-10%を上回った場合に、
中和抗体応答率に基づく免疫ブリッジング成功とした。
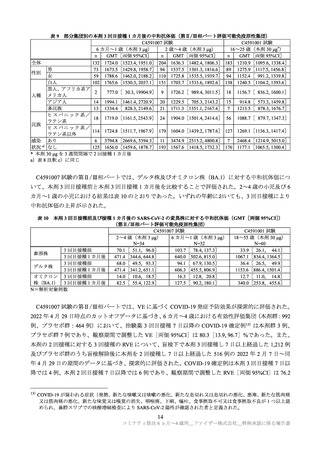
免疫ブリッジングの評価対象集団は、GMR 及び中和抗体応答率の判定基準をそれぞれ 90%以上の検
出力で達成するためには各年齢層の本剤群として約 225 例必要であるとされたことを参考に、3 つの年
齢層(C4591007 試験:6 カ月~1 歳、2~4 歳、C4591001 試験(比較対照):16~25 歳)から、それぞ
れ本剤群 200~300 例及びプラセボ群 50~150 例が無作為に抽出され、血清学的又はウイルス学的に
SARS-CoV-2 への感染歴がない被験者が解析対象とされた。
C4591007 試験の 2~4 歳 317 例(本剤群:218 例、プラセボ群:99 例、以下同順)、6 カ月~1 歳 222
例(148 例、74 例)が無作為抽出され、このうち、規定された接種期間内に免疫原性の測定結果が得ら
れなかった、3 回目を接種しなかった又は治験実施計画からの重大な逸脱の理由で、2~4 歳の 21 例(14
9
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書
例)に認められた。各年齢層で認められた重篤な有害事象は以下のとおりであった(重複症例あり)。
2~4 歳
本剤群:虫垂炎及び脱水各 2 例、下痢、発熱、限局性腹膜炎、ロタウイルス性胃腸炎、ウイルス性胃
腸炎、下気道感染、上気道感染、四肢痛、てんかん、熱性痙攣及びてんかん重積状態各 1 例
プラセボ群:視神経乳頭浮腫、胃腸炎、アデノウイルス性胃腸炎、ロタウイルス胃腸炎、体内異物、
てんかん、熱性痙攣及び気管支反応性亢進各 1 例
6 カ月~1 歳
本剤群:RS ウイルス細気管支炎 4 例、胃腸炎及び肺炎各 2 例、アナフィラキシー反応、肛門膿瘍、エ
ンテロウイルス感染、ロタウイルス胃腸炎、ウイルス性胃腸炎、大腸感染、下気道感染、ウ
イルス性下気道感染、メタニューモウイルス感染、RS ウイルス感染、ライノウイルス感染、
偶発的過量投与、熱性痙攣及び痙攣発作各 1 例
プラセボ群:細気管支炎及びチアノーゼ各 2 例、嘔吐、アナフィラキシー反応、ノロウイルス性胃腸
炎、ロタウイルス胃腸炎、RS ウイルス細気管支炎、扁桃炎、ウイルス感染、第 2 度熱傷、頭
部損傷、熱傷、栄養補給不耐性、低血糖、気縦隔症及び呼吸窮迫各 1 例
2~4 歳の本剤群の発熱及び四肢痛、6 カ月~1 歳のプラセボ群のチアノーゼを除き、治験薬との因果
関係は否定され、転帰は軽快又は回復であった。
治験中止に至った有害事象は、2~4 歳の本剤群 3 例(発熱、てんかん重積状態及び蕁麻疹各 1 例)、
プラセボ群 1 例(顔面腫脹及び斑状皮疹)に、6 カ月~1 歳の本剤群 2 例(発熱 2 例及び発疹 1 例(重複
症例あり))に認められ、てんかん重積状態を除き本剤との因果関係はありとされ、いずれも転帰は回
復であった。
免疫原性については、GMR と中和抗体応答率を評価指標とし、以下の判定基準により C4591007 試験
と C4591001 試験の成績を比較して、免疫ブリッジングの成否が評価された。
GMR:GMR の両側 95%信頼区間の下限が 0.67 を上回り、かつ GMR の点推定値が 0.8 以上(治験
実施計画書の規定)又は 1 以上(FDA の定義)であった場合に GMR に基づく免疫ブリッジング成
功とした。
中和抗体応答率:ベースライン(1 回目接種前)から SARS-CoV-2 中和抗体価が 4 倍以上に上昇し
た被験者の割合を抗体応答率と定義し、ベースライン値が定量下限値(LLOQ)未満の場合は、ワク
チン接種後の値が LLOQ の 4 倍以上のときに抗体応答とした。GMR に基づく免疫ブリッジングが
達成された条件の下で、中和抗体応答率の差の両側 95%信頼区間の下限が-10%を上回った場合に、
中和抗体応答率に基づく免疫ブリッジング成功とした。
免疫ブリッジングの評価対象集団は、GMR 及び中和抗体応答率の判定基準をそれぞれ 90%以上の検
出力で達成するためには各年齢層の本剤群として約 225 例必要であるとされたことを参考に、3 つの年
齢層(C4591007 試験:6 カ月~1 歳、2~4 歳、C4591001 試験(比較対照):16~25 歳)から、それぞ
れ本剤群 200~300 例及びプラセボ群 50~150 例が無作為に抽出され、血清学的又はウイルス学的に
SARS-CoV-2 への感染歴がない被験者が解析対象とされた。
C4591007 試験の 2~4 歳 317 例(本剤群:218 例、プラセボ群:99 例、以下同順)、6 カ月~1 歳 222
例(148 例、74 例)が無作為抽出され、このうち、規定された接種期間内に免疫原性の測定結果が得ら
れなかった、3 回目を接種しなかった又は治験実施計画からの重大な逸脱の理由で、2~4 歳の 21 例(14
9
コミナティ筋注 6 ヵ月~4 歳用_ファイザー株式会社_特例承認に係る報告書