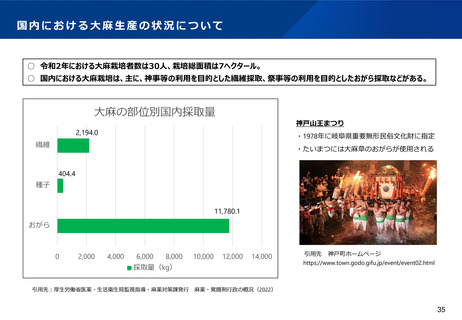
よむ、つかう、まなぶ。
資料3 大麻取締法等の改正に向けた検討状況について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27261.html |
| 出典情報 | 厚生科学審議会 医薬品医療機器制度部会(令和4年度第1回 8/5)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
1
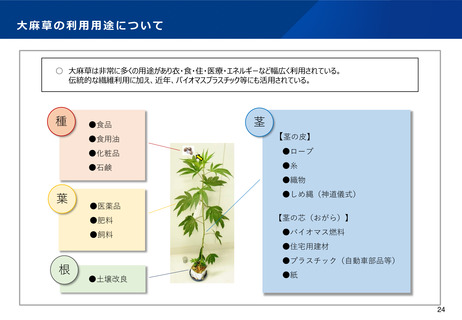
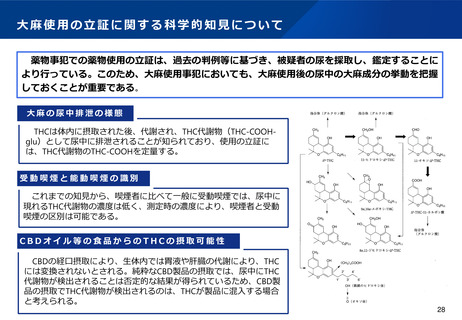
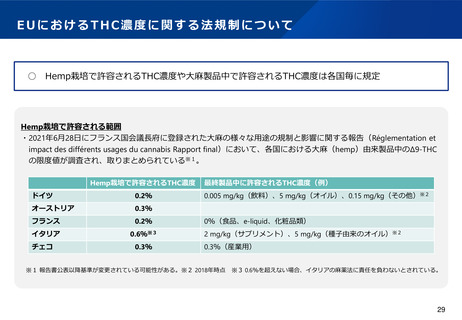
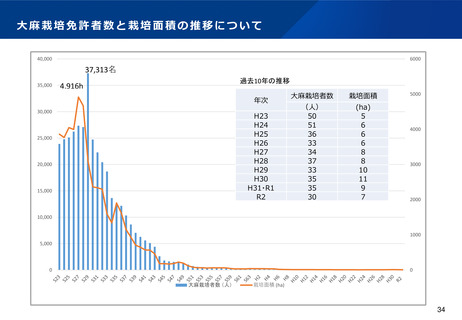
医療ニーズへの対応(大麻由来医薬品に係る取扱い①)
現状及び課題
○ 大麻から製造された医薬品について、重度のてんかん症候群であるレノックス・ガストー症候群及び
ドラベ症候群の治療薬(商品名:エピディオレックス)は、米国を始めとするG7諸国において承認
されている。
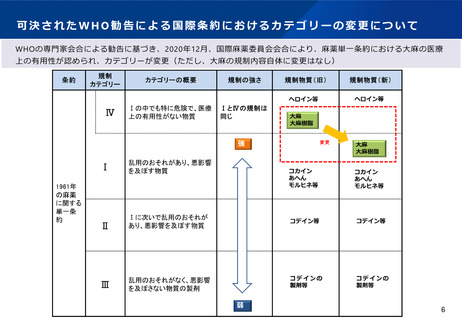
○ また、麻薬単一条約において、これまで大麻の位置付けは「Ⅰ(乱用のおそれがあり、悪影響を及ぼ
す物質)」及び「Ⅳ(特に貴見で医療用途がない物質)」という規制カテゴリーに位置付けられてい
たが、WHO専門家会合の勧告を踏まえ、令和2(2020)年の国連麻薬委員会の会合において、Ⅳのカ
テゴリーから外すことが可決された。これにより、依然として、Ⅰとしての規制を課すことは求めら
れつつ、医療上の有用性が認められた。
○ 日本においても、上記のエピディオレックスについて、国内治験の実施に向けた申請がなされている
状況となっている。一方、現行の大麻取締法においては、大麻から製造された医薬品について、大麻
研究者である医師の下、適切な実施計画に基づき治験を行うことは可能ではあるものの、大麻から製
造された医薬品の施用・受施用、規制部位から抽出された大麻製品の輸入を禁止していることから、
仮に、医薬品医療機器等法に基づく承認がなされたとしても、医療現場において活用することは困難
となっている。
7
医療ニーズへの対応(大麻由来医薬品に係る取扱い①)
現状及び課題
○ 大麻から製造された医薬品について、重度のてんかん症候群であるレノックス・ガストー症候群及び
ドラベ症候群の治療薬(商品名:エピディオレックス)は、米国を始めとするG7諸国において承認
されている。
○ また、麻薬単一条約において、これまで大麻の位置付けは「Ⅰ(乱用のおそれがあり、悪影響を及ぼ
す物質)」及び「Ⅳ(特に貴見で医療用途がない物質)」という規制カテゴリーに位置付けられてい
たが、WHO専門家会合の勧告を踏まえ、令和2(2020)年の国連麻薬委員会の会合において、Ⅳのカ
テゴリーから外すことが可決された。これにより、依然として、Ⅰとしての規制を課すことは求めら
れつつ、医療上の有用性が認められた。
○ 日本においても、上記のエピディオレックスについて、国内治験の実施に向けた申請がなされている
状況となっている。一方、現行の大麻取締法においては、大麻から製造された医薬品について、大麻
研究者である医師の下、適切な実施計画に基づき治験を行うことは可能ではあるものの、大麻から製
造された医薬品の施用・受施用、規制部位から抽出された大麻製品の輸入を禁止していることから、
仮に、医薬品医療機器等法に基づく承認がなされたとしても、医療現場において活用することは困難
となっている。
7