よむ、つかう、まなぶ。
総-3参考9 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_67369.html |
| 出典情報 | 中央社会保険医療協議会 総会(第636回 12/17)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
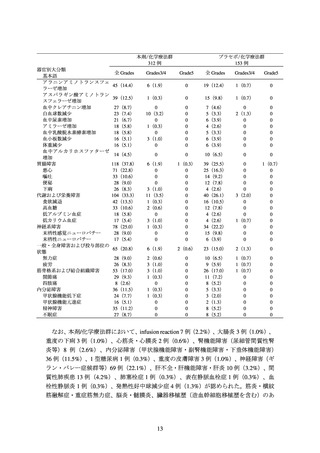
3.臨床成績
切除不能な進行・再発の非小細胞肺癌の承認時に評価を行った主な臨床試験の成績を
示す。
【有効性】
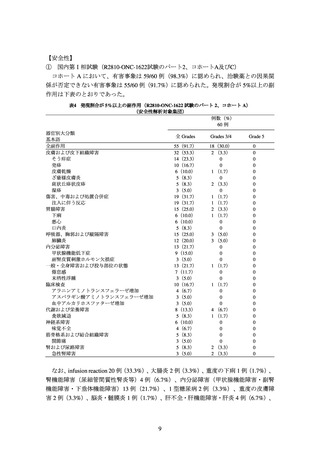
① 国内第I相試験(R2810-ONC-1622 試験のパート 2、コホート A 及び C)
(ⅰ)化学療法歴のない PD-L1 陽性*1 の切除不能な進行・再発の非小細胞肺癌患者
(コホート A:60 例)及び(ⅱ)化学療法歴のない切除不能な進行・再発の非小細胞肺
癌患者(コホート C:50 例)*2 を対象に、それぞれ(ⅰ)本剤 350 mg を 3 週間間隔で
静脈内投与及び(ⅱ)本剤 350 mg を 3 週間間隔で静脈内投与と化学療法*3 との併用の
安全性、薬物動態等を検討することを目的とした非盲検非対照試験が実施された。
副次評価項目の一つとされた RECIST ver.1.1 に基づく独立判定委員会判定による奏
効率(完全奏効又は部分奏効)は、コホート A 及び C でそれぞれ 60.0[90%信頼区間:
48.6, 71.4]%*4 及び 42.0[90%信頼区間:30.5, 53.5]%であった*5。なお、コホート C で
は、事前に設定された奏効率の閾値は 28%であり、コホート A では、事前に奏効率の
閾値は設定されなかった。
*1:腫瘍細胞の 50%以上に PD-L1 が発現していることが確認された患者が組み入れられた。
*2:上皮増殖因子受容体(以下、「EGFR」)遺伝子変異、未分化リンパ腫キナーゼ(以下、「ALK」)
融合遺伝子又は c-ros oncogene 1(以下、「ROS1」)融合遺伝子陽性の患者は対象外とされた。
*3:治験担当医師により、以下のいずれかが選択された。
白金製剤(カルボプラチン又はシスプラチン)とパクリタキセルを 3 週間間隔で 4 回静脈
内投与
白金製剤(カルボプラチン又はシスプラチン)とペメトレキセドナトリウムを 3 週間間隔
で 4 回静脈内投与した後、ペメトレキセドナトリウムを 3 週間間隔で静脈内投与
*4:中央検査で PD-L1 発現率が 50%以上であることが確認されなかった 10 例を除く 50 例が有効性
解析対象とされた。
*5:コホート A は 2023 年 9 月 5 日データカットオフ、コホート C は 2023 年 10 月 18 日データカッ
トオフ
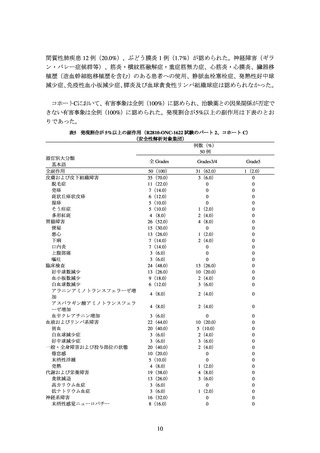
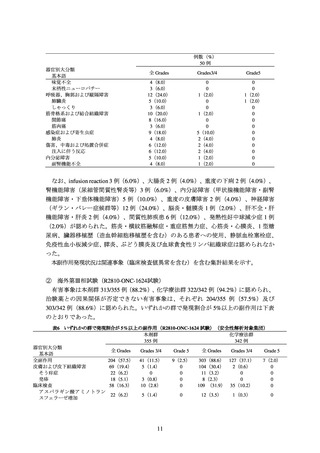
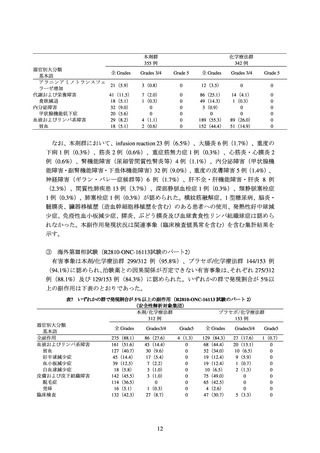
② 海外第Ⅲ相試験(R2810-ONC-1624 試験)
化学療法歴のない PD-L1 陽性*1 の切除不能な進行・再発の非小細胞肺癌患者*2710 例
を対象に、本剤 350 mg を 3 週間間隔で静脈内投与(本剤群:356 例)と化学療法*3(化
学療法群:354 例)の有効性及び安全性を比較することを目的とした無作為化非盲検比
較試験が実施された。
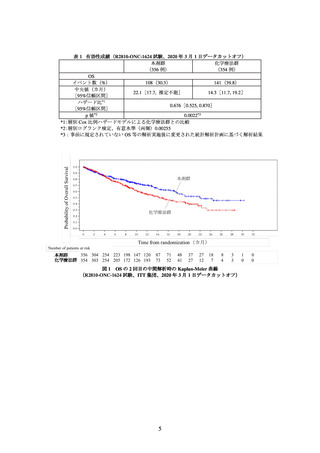
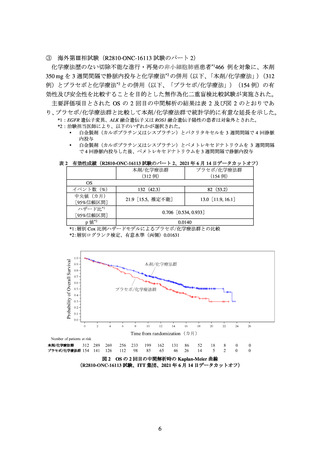
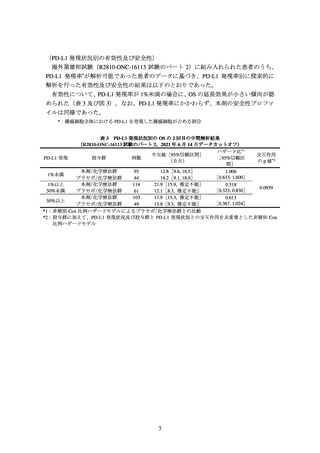
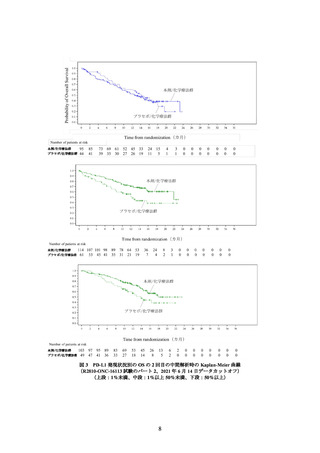
主要評価項目の一つとされた全生存期間(以下、「OS」)の 2 回目の中間解析の結果
は、表 1 及び図 1 のとおりであった。
*1:腫瘍細胞の 50%以上に PD-L1 が発現していることが確認された患者が組み入れられた。
*2:EGFR 遺伝子変異、ALK 融合遺伝子又は ROS1 融合遺伝子陽性の患者は対象外とされた。
*3:治験担当医師により、以下のいずれかが選択された。
白金製剤(カルボプラチン又はシスプラチン)とパクリタキセルを 3 週間間隔で 4~6 回静
脈内投与
白金製剤(カルボプラチン又はシスプラチン)とペメトレキセドナトリウムを 3 週間間隔
で 4~6 回静脈内投与した後、ペメトレキセドナトリウムを 3 週間間隔で静脈内投与
3 週間を 1 サイクルとして、白金製剤(カルボプラチン又はシスプラチン)を第 1 日目、ゲ
ムシタビン塩酸塩を第 1 及び 8 日目に 4~6 回静脈内投与
4
切除不能な進行・再発の非小細胞肺癌の承認時に評価を行った主な臨床試験の成績を
示す。
【有効性】
① 国内第I相試験(R2810-ONC-1622 試験のパート 2、コホート A 及び C)
(ⅰ)化学療法歴のない PD-L1 陽性*1 の切除不能な進行・再発の非小細胞肺癌患者
(コホート A:60 例)及び(ⅱ)化学療法歴のない切除不能な進行・再発の非小細胞肺
癌患者(コホート C:50 例)*2 を対象に、それぞれ(ⅰ)本剤 350 mg を 3 週間間隔で
静脈内投与及び(ⅱ)本剤 350 mg を 3 週間間隔で静脈内投与と化学療法*3 との併用の
安全性、薬物動態等を検討することを目的とした非盲検非対照試験が実施された。
副次評価項目の一つとされた RECIST ver.1.1 に基づく独立判定委員会判定による奏
効率(完全奏効又は部分奏効)は、コホート A 及び C でそれぞれ 60.0[90%信頼区間:
48.6, 71.4]%*4 及び 42.0[90%信頼区間:30.5, 53.5]%であった*5。なお、コホート C で
は、事前に設定された奏効率の閾値は 28%であり、コホート A では、事前に奏効率の
閾値は設定されなかった。
*1:腫瘍細胞の 50%以上に PD-L1 が発現していることが確認された患者が組み入れられた。
*2:上皮増殖因子受容体(以下、「EGFR」)遺伝子変異、未分化リンパ腫キナーゼ(以下、「ALK」)
融合遺伝子又は c-ros oncogene 1(以下、「ROS1」)融合遺伝子陽性の患者は対象外とされた。
*3:治験担当医師により、以下のいずれかが選択された。
白金製剤(カルボプラチン又はシスプラチン)とパクリタキセルを 3 週間間隔で 4 回静脈
内投与
白金製剤(カルボプラチン又はシスプラチン)とペメトレキセドナトリウムを 3 週間間隔
で 4 回静脈内投与した後、ペメトレキセドナトリウムを 3 週間間隔で静脈内投与
*4:中央検査で PD-L1 発現率が 50%以上であることが確認されなかった 10 例を除く 50 例が有効性
解析対象とされた。
*5:コホート A は 2023 年 9 月 5 日データカットオフ、コホート C は 2023 年 10 月 18 日データカッ
トオフ
② 海外第Ⅲ相試験(R2810-ONC-1624 試験)
化学療法歴のない PD-L1 陽性*1 の切除不能な進行・再発の非小細胞肺癌患者*2710 例
を対象に、本剤 350 mg を 3 週間間隔で静脈内投与(本剤群:356 例)と化学療法*3(化
学療法群:354 例)の有効性及び安全性を比較することを目的とした無作為化非盲検比
較試験が実施された。
主要評価項目の一つとされた全生存期間(以下、「OS」)の 2 回目の中間解析の結果
は、表 1 及び図 1 のとおりであった。
*1:腫瘍細胞の 50%以上に PD-L1 が発現していることが確認された患者が組み入れられた。
*2:EGFR 遺伝子変異、ALK 融合遺伝子又は ROS1 融合遺伝子陽性の患者は対象外とされた。
*3:治験担当医師により、以下のいずれかが選択された。
白金製剤(カルボプラチン又はシスプラチン)とパクリタキセルを 3 週間間隔で 4~6 回静
脈内投与
白金製剤(カルボプラチン又はシスプラチン)とペメトレキセドナトリウムを 3 週間間隔
で 4~6 回静脈内投与した後、ペメトレキセドナトリウムを 3 週間間隔で静脈内投与
3 週間を 1 サイクルとして、白金製剤(カルボプラチン又はシスプラチン)を第 1 日目、ゲ
ムシタビン塩酸塩を第 1 及び 8 日目に 4~6 回静脈内投与
4