よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-1)[2.1MB] (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
るため、B と判断する。
総合的なコメント欄
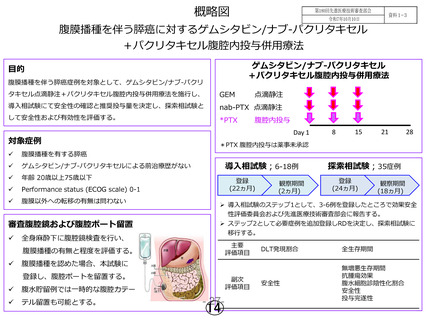
本試験の結果から、腹膜播種を伴う膵臓がんに対する
ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内投
与及びパクリタキセル腹腔内投与の併用療法の一定の有
効性は示され、安全性に関しても重篤な有害事象の発現
はあるものの、疾患の特異性を考慮しても臨床的には許
容できる範囲と考える。今回、次相の実施に資する結果
が得られたと判断する。
薬事未承認の医薬品等
本試験の結果から、一定の有用性を示すデータは得られて
を伴う医療技術の場
いると考える。本試験の対象疾患に対する薬事承認申請が
合、薬事承認申請の効
行われるのであれば、本技術の薬事承認申請の効率化には
率化に資するかどうか
一定程度資するものと判断する。
等についての助言欄
副担当: 飛田構成員
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
コメント欄:本試験は推奨用量を決定する第 I 相パートと決定された推奨用量で
の有効性・安全性を確認する第 II 相パートからなるデザインで実施された。有効
性については、推奨投与量(RD)症例 35 例(第 II 相パート 32 例、第 I 相パート
RD 投与 3 例)の全生存期間の中央値 12.9 か月であり、80%信頼区間 9.5~18.9、
95%信頼区間 9.0~19.5 と、計画時点で設定された標準治療による全生存期間の閾
値 7 か月を上回っていることから、非盲検非対照試験の成績ではあるものの、次
の医師主導治験に進むに足る結果が得られたとのことから、B と判断しています。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
- 70-
6
総合的なコメント欄
本試験の結果から、腹膜播種を伴う膵臓がんに対する
ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内投
与及びパクリタキセル腹腔内投与の併用療法の一定の有
効性は示され、安全性に関しても重篤な有害事象の発現
はあるものの、疾患の特異性を考慮しても臨床的には許
容できる範囲と考える。今回、次相の実施に資する結果
が得られたと判断する。
薬事未承認の医薬品等
本試験の結果から、一定の有用性を示すデータは得られて
を伴う医療技術の場
いると考える。本試験の対象疾患に対する薬事承認申請が
合、薬事承認申請の効
行われるのであれば、本技術の薬事承認申請の効率化には
率化に資するかどうか
一定程度資するものと判断する。
等についての助言欄
副担当: 飛田構成員
有効性
A.従来の医療技術を用いるよりも、大幅に有効であ
る。
B.従来の医療技術を用いるよりも、やや有効である。
C.従来の医療技術を用いるのと、同程度である。
D.従来の医療技術を用いるよりも、劣る。
E.その他
コメント欄:本試験は推奨用量を決定する第 I 相パートと決定された推奨用量で
の有効性・安全性を確認する第 II 相パートからなるデザインで実施された。有効
性については、推奨投与量(RD)症例 35 例(第 II 相パート 32 例、第 I 相パート
RD 投与 3 例)の全生存期間の中央値 12.9 か月であり、80%信頼区間 9.5~18.9、
95%信頼区間 9.0~19.5 と、計画時点で設定された標準治療による全生存期間の閾
値 7 か月を上回っていることから、非盲検非対照試験の成績ではあるものの、次
の医師主導治験に進むに足る結果が得られたとのことから、B と判断しています。
安全性
A.問題なし。(ほとんど副作用、合併症なし)
B.あまり問題なし。(軽い副作用、合併症あり)
C.問題あり。(重い副作用、合併症が発生することあ
り)
- 70-
6