よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-1)[2.1MB] (1 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
第181回先進医療技術審査部会
令和7年11月13日
先進医療B
評価委員
第180回先進医療技術審査部会
資料7
令和7年10月10日
総括報告書に関する評価表(告示旧 B7)
主担当:
平田
副担当:
飛田
資料1-1
別紙3-1
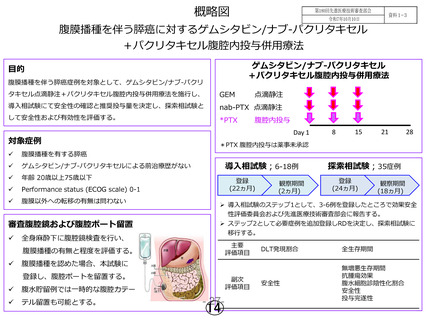
先 進 医 療 ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内投与及びパク
の名称
リタキセル腹腔内投与の併用療法 腹膜播種を伴う膵臓がん
申 請 医 療 東京大学医学部附属病院
機関
医療技術
の概要
ゲムシタビン不応となった腹膜播種を伴う膵癌症例を対象とした
臨床試験により、S-1とパクリタキセル経静脈および腹腔内投与併用
療法の安全性および有効性が報告された。腹膜播種の制御の可能性
が示された一方で、原発巣や他臓器転移の制御には限界があること
が示唆された。更なる生存期間延長のためには、より強力な全身化
学療法との併用が必要であると考えられた。そのため切除不能進行
膵癌に2014年に本邦で保険承認されたゲムシタビン/ナブ-パクリタ
キセル療法に、パクリタキセル腹腔内投与を併用する治療法を考案
した。
本研究では腹膜播種を伴う膵癌に対する新たな治療法の開発を目
指し、ゲムシタビン/ナブ-パクリタキセル点滴静注+パクリタキセ
ル腹腔内投与併用療法を施行し、導入相試験にて安全性の確認と推
奨投与量の決定を行い、引き続き探索相試験にて安全性および有効
性の評価を行う。
○主要評価項目:
第Ⅰ相試験
安全性評価基準:用量制限毒性(Dose limiting toxicity: DLT)
第Ⅱ相試験
有効性評価基準:全生存期間
○副次評価項目:
第Ⅰ相相試験
安全性評価基準:有害事象の発生
第Ⅱ相試験
- 65-
1
令和7年11月13日
先進医療B
評価委員
第180回先進医療技術審査部会
資料7
令和7年10月10日
総括報告書に関する評価表(告示旧 B7)
主担当:
平田
副担当:
飛田
資料1-1
別紙3-1
先 進 医 療 ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内投与及びパク
の名称
リタキセル腹腔内投与の併用療法 腹膜播種を伴う膵臓がん
申 請 医 療 東京大学医学部附属病院
機関
医療技術
の概要
ゲムシタビン不応となった腹膜播種を伴う膵癌症例を対象とした
臨床試験により、S-1とパクリタキセル経静脈および腹腔内投与併用
療法の安全性および有効性が報告された。腹膜播種の制御の可能性
が示された一方で、原発巣や他臓器転移の制御には限界があること
が示唆された。更なる生存期間延長のためには、より強力な全身化
学療法との併用が必要であると考えられた。そのため切除不能進行
膵癌に2014年に本邦で保険承認されたゲムシタビン/ナブ-パクリタ
キセル療法に、パクリタキセル腹腔内投与を併用する治療法を考案
した。
本研究では腹膜播種を伴う膵癌に対する新たな治療法の開発を目
指し、ゲムシタビン/ナブ-パクリタキセル点滴静注+パクリタキセ
ル腹腔内投与併用療法を施行し、導入相試験にて安全性の確認と推
奨投与量の決定を行い、引き続き探索相試験にて安全性および有効
性の評価を行う。
○主要評価項目:
第Ⅰ相試験
安全性評価基準:用量制限毒性(Dose limiting toxicity: DLT)
第Ⅱ相試験
有効性評価基準:全生存期間
○副次評価項目:
第Ⅰ相相試験
安全性評価基準:有害事象の発生
第Ⅱ相試験
- 65-
1