よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-1)[2.1MB] (2 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
安全性評価基準:有害事象の発生
有効性評価基準:
1) 抗腫瘍効果(奏効率・病勢制御率)
2) 無増悪生存期間
3) 投与完遂性
4) 腹水細胞診陰性化率
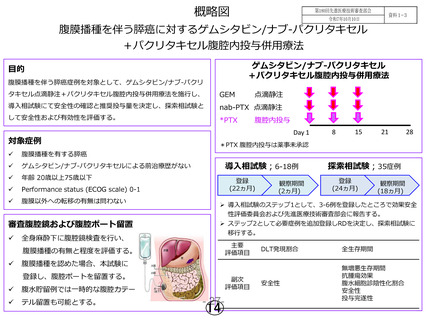
○目標症例数:
導入相試験 6~18 人、探索相試験 35 人
(導入相試験のうち推奨投与量で治療を開始した症例を探索相試験の
解析対象に含める。) (登録症例数:44 例)
○試験期間:
2016年10月~2024年9月
医 療 技 術 ○安全性の評価結果
の試験結
果
第Ⅰ相試験の主要評価項目である DLT 発現割合はコホートレベル
1 で 2 例が DLT(2/6 例)と判定され、33.3%であった。コホートレベル
2 とコホートレベル 3 ではともに DLT がなく、0%であった。第Ⅰ相試
験全体では DLT は 2/12 例で 16.7%であった。
CTCAE grade 3 以上の主な有害事象は好中球数減少 (46.9%)、白血
球減少 (30.6%)、貧血(18.4%)、発熱性好中球減少症(10.2%)、カテー
テル留置部位感染(8.2%)であった。試験治療との因果関係が否定でき
ない重篤な有害事象は 15 件報告された。そのうち 1 件(発熱性好中
球減少症)は死亡例であった。それ以外の 14 件は「入院又は入院期間
の延長」が 13 件、
「準じて重篤」が 1 件であり、適切な処置により回
復した。
腹腔ポート関連合併症は 9 件報告された。全例が再手術、ポート抜
去、ポート再固定などの適切な処置により回復した。
以上より、ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内
投与及びパクリタキセル腹腔内投与の併用療法は安全に実施可能で
あったと考えられる。
○有効性の評価結果
本研究の第Ⅱ相試験の主要評価項目である全生存期間中央値は12.9
ヵ月であった。主要評価項目である全生存期間は中央値12.9ヵ月と
- 66-
2
有効性評価基準:
1) 抗腫瘍効果(奏効率・病勢制御率)
2) 無増悪生存期間
3) 投与完遂性
4) 腹水細胞診陰性化率
○目標症例数:
導入相試験 6~18 人、探索相試験 35 人
(導入相試験のうち推奨投与量で治療を開始した症例を探索相試験の
解析対象に含める。) (登録症例数:44 例)
○試験期間:
2016年10月~2024年9月
医 療 技 術 ○安全性の評価結果
の試験結
果
第Ⅰ相試験の主要評価項目である DLT 発現割合はコホートレベル
1 で 2 例が DLT(2/6 例)と判定され、33.3%であった。コホートレベル
2 とコホートレベル 3 ではともに DLT がなく、0%であった。第Ⅰ相試
験全体では DLT は 2/12 例で 16.7%であった。
CTCAE grade 3 以上の主な有害事象は好中球数減少 (46.9%)、白血
球減少 (30.6%)、貧血(18.4%)、発熱性好中球減少症(10.2%)、カテー
テル留置部位感染(8.2%)であった。試験治療との因果関係が否定でき
ない重篤な有害事象は 15 件報告された。そのうち 1 件(発熱性好中
球減少症)は死亡例であった。それ以外の 14 件は「入院又は入院期間
の延長」が 13 件、
「準じて重篤」が 1 件であり、適切な処置により回
復した。
腹腔ポート関連合併症は 9 件報告された。全例が再手術、ポート抜
去、ポート再固定などの適切な処置により回復した。
以上より、ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈内
投与及びパクリタキセル腹腔内投与の併用療法は安全に実施可能で
あったと考えられる。
○有効性の評価結果
本研究の第Ⅱ相試験の主要評価項目である全生存期間中央値は12.9
ヵ月であった。主要評価項目である全生存期間は中央値12.9ヵ月と
- 66-
2