よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-1)[2.1MB] (14 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
概略図
第180回先進医療技術審査部会
資料1−3
令和7年10月10日
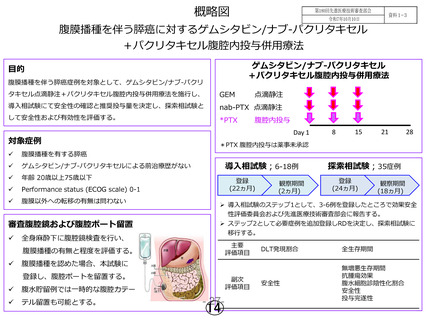
腹膜播種を伴う膵癌に対するゲムシタビン/ナブ-パクリタキセル
+パクリタキセル腹腔内投与併用療法
ゲムシタビン/ナブ-パクリタキセル
+パクリタキセル腹腔内投与併用療法
目的
腹膜播種を伴う膵癌症例を対象として、ゲムシタビン/ナブ-パクリ
タキセル点滴静注+パクリタキセル腹腔内投与併用療法を施行し、
GEM
導入相試験にて安全性の確認と推奨投与量を決定し、探索相試験と
nab-PTX 点滴静注
して安全性および有効性を評価する。
*PTX
対象症例
✓
腹膜播種を有する膵癌
✓
ゲムシタビン/ナブ-パクリタキセルによる前治療歴がない
✓
年齢 20歳以上75歳以下
✓
Performance status (ECOG scale) 0-1
✓
腹膜以外への転移の有無は問わない
審査腹腔鏡および腹腔ポート留置
✓
腹腔内投与
Day 1
探索相試験;35症例
登録
(22ヵ月)
登録
(24ヵ月)
観察期間
(2ヵ月)
テル留置も可能とする。
28
観察期間
(18ヵ月)
移行する。
主要
評価項目
登録し、腹腔ポートを留置する。
✓
21
導入相試験;6-18例
DLT発現割合
全生存期間
安全性
無増悪生存期間
抗腫瘍効果
腹水細胞診陰性化割合
安全性
投与完遂性
腹膜播種を認めた場合、本試験に
腹水貯留例では一時的な腹腔カテー
15
➢ 導入相試験のステップ1として、3-6例を登録したところで効果安全
性評価委員会および先進医療技術審査部会に報告する。
➢ ステップ2として必要症例を追加登録しRDを決定し、探索相試験に
全身麻酔下に腹腔鏡検査を行い、
✓
8
*PTX 腹腔内投与は薬事未承認
腹膜播種の有無と程度を評価する。
✓
点滴静注
副次
評価項目
- 27-
14
第180回先進医療技術審査部会
資料1−3
令和7年10月10日
腹膜播種を伴う膵癌に対するゲムシタビン/ナブ-パクリタキセル
+パクリタキセル腹腔内投与併用療法
ゲムシタビン/ナブ-パクリタキセル
+パクリタキセル腹腔内投与併用療法
目的
腹膜播種を伴う膵癌症例を対象として、ゲムシタビン/ナブ-パクリ
タキセル点滴静注+パクリタキセル腹腔内投与併用療法を施行し、
GEM
導入相試験にて安全性の確認と推奨投与量を決定し、探索相試験と
nab-PTX 点滴静注
して安全性および有効性を評価する。
*PTX
対象症例
✓
腹膜播種を有する膵癌
✓
ゲムシタビン/ナブ-パクリタキセルによる前治療歴がない
✓
年齢 20歳以上75歳以下
✓
Performance status (ECOG scale) 0-1
✓
腹膜以外への転移の有無は問わない
審査腹腔鏡および腹腔ポート留置
✓
腹腔内投与
Day 1
探索相試験;35症例
登録
(22ヵ月)
登録
(24ヵ月)
観察期間
(2ヵ月)
テル留置も可能とする。
28
観察期間
(18ヵ月)
移行する。
主要
評価項目
登録し、腹腔ポートを留置する。
✓
21
導入相試験;6-18例
DLT発現割合
全生存期間
安全性
無増悪生存期間
抗腫瘍効果
腹水細胞診陰性化割合
安全性
投与完遂性
腹膜播種を認めた場合、本試験に
腹水貯留例では一時的な腹腔カテー
15
➢ 導入相試験のステップ1として、3-6例を登録したところで効果安全
性評価委員会および先進医療技術審査部会に報告する。
➢ ステップ2として必要症例を追加登録しRDを決定し、探索相試験に
全身麻酔下に腹腔鏡検査を行い、
✓
8
*PTX 腹腔内投与は薬事未承認
腹膜播種の有無と程度を評価する。
✓
点滴静注
副次
評価項目
- 27-
14