よむ、つかう、まなぶ。
3 先進医療Bの総括報告書に関する評価について(別紙3-1)[2.1MB] (3 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000205617_00111.html |
| 出典情報 | 先進医療会議(第149回 12/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
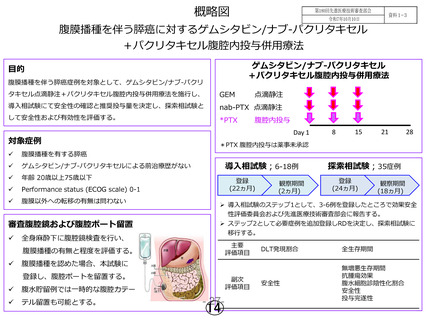
期待値を超え、また80%信頼区間下限値が9.5ヵ月と閾値を上回った
ことから、本試験治療は「有効である」と評価した。
副次評価項目である抗腫瘍効果(奏効率・病勢制御率)は奏効率
28.6%、病勢抑制率88.6%であった。無増悪生存期間中央値は6.0ヵ月
であった。また治療開始前に腹腔洗浄細胞診陽性であった23例にお
ける、治療後の腹腔洗浄細胞診陰性化率は78.3%であった。
○結論
転移性膵癌に対するゲムシタビン+ナブ-パクリタキセル併用療法
の第Ⅲ相試験(M-PACT 試験)において、腹膜播種例の全生存期間は 7.6
ヵ月と報告されている。そのため本研究では対象症例の標準治療によ
る全生存期間を 7 ヵ月(閾値)、試験治療による全生存期間を 12 ヵ月
(期待値)として目標症例数を算出した。そのうえで、試験治療による
全生存期間中央値の 80%信頼区間下限値が閾値の 7 ヵ月を超えた場
合、試験治療が「有効である」とするという判断基準を設けた。
本研究の第Ⅱ相試験の主要評価項目である全生存期間は中央値
12.9 ヵ月と期待値を超え、また 80%信頼区間下限値が 9.5 ヵ月と閾
値を上回ったことから、本試験治療は「有効である」と評価した。
全期間の相対薬剤強度は、ゲムシタビン 68.56±18.03%(最大値
96.0、最小値 25.9)、ナブ-パクリタキセル 68.06±17.53%(最大値
96.0、最小値 25.9)、パクリタキセル 60.79±16.38%(最大値 93.3、
最小値 25.9)であった。
試験治療との因果関係が否定できない重篤な有害事象が 15 件報告
された。その内訳は、
「死亡」が 1 件、
「入院又は入院期間の延長」が
13 件、
「準じて重篤」が 1 件であった。死亡例の直接死因は原病の進
行に伴う消化管穿孔と考えられたが、試験治療に関連する発熱性好中
球減少症も併発しており、病勢の悪化に影響した可能性が除外しきれ
ないことから、試験治療との因果関係が否定できないと判断された。
それ以外の 14 件の重篤な有害事象は、いずれも適切な処置により回
復した。また腹腔ポート関連合併症は 9 件報告され、このうち未知の
合併症として小腸穿孔 2 件、既知の合併症として腹腔ポート感染 4
件、閉塞 2 件、腹水漏出 1 例が生じたが、いずれも再手術、ポート抜
去、ポート再固定などの適切な処置により回復した。
以上により、ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈
- 67-
3
ことから、本試験治療は「有効である」と評価した。
副次評価項目である抗腫瘍効果(奏効率・病勢制御率)は奏効率
28.6%、病勢抑制率88.6%であった。無増悪生存期間中央値は6.0ヵ月
であった。また治療開始前に腹腔洗浄細胞診陽性であった23例にお
ける、治療後の腹腔洗浄細胞診陰性化率は78.3%であった。
○結論
転移性膵癌に対するゲムシタビン+ナブ-パクリタキセル併用療法
の第Ⅲ相試験(M-PACT 試験)において、腹膜播種例の全生存期間は 7.6
ヵ月と報告されている。そのため本研究では対象症例の標準治療によ
る全生存期間を 7 ヵ月(閾値)、試験治療による全生存期間を 12 ヵ月
(期待値)として目標症例数を算出した。そのうえで、試験治療による
全生存期間中央値の 80%信頼区間下限値が閾値の 7 ヵ月を超えた場
合、試験治療が「有効である」とするという判断基準を設けた。
本研究の第Ⅱ相試験の主要評価項目である全生存期間は中央値
12.9 ヵ月と期待値を超え、また 80%信頼区間下限値が 9.5 ヵ月と閾
値を上回ったことから、本試験治療は「有効である」と評価した。
全期間の相対薬剤強度は、ゲムシタビン 68.56±18.03%(最大値
96.0、最小値 25.9)、ナブ-パクリタキセル 68.06±17.53%(最大値
96.0、最小値 25.9)、パクリタキセル 60.79±16.38%(最大値 93.3、
最小値 25.9)であった。
試験治療との因果関係が否定できない重篤な有害事象が 15 件報告
された。その内訳は、
「死亡」が 1 件、
「入院又は入院期間の延長」が
13 件、
「準じて重篤」が 1 件であった。死亡例の直接死因は原病の進
行に伴う消化管穿孔と考えられたが、試験治療に関連する発熱性好中
球減少症も併発しており、病勢の悪化に影響した可能性が除外しきれ
ないことから、試験治療との因果関係が否定できないと判断された。
それ以外の 14 件の重篤な有害事象は、いずれも適切な処置により回
復した。また腹腔ポート関連合併症は 9 件報告され、このうち未知の
合併症として小腸穿孔 2 件、既知の合併症として腹腔ポート感染 4
件、閉塞 2 件、腹水漏出 1 例が生じたが、いずれも再手術、ポート抜
去、ポート再固定などの適切な処置により回復した。
以上により、ゲムシタビン静脈内投与、ナブ-パクリタキセル静脈
- 67-
3