よむ、つかう、まなぶ。
費-1日本製薬団体連合会、日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_65756.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第74回 11/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
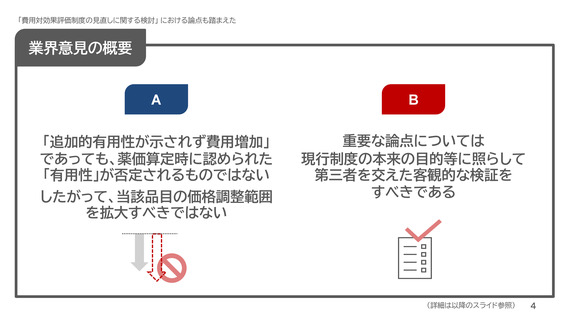
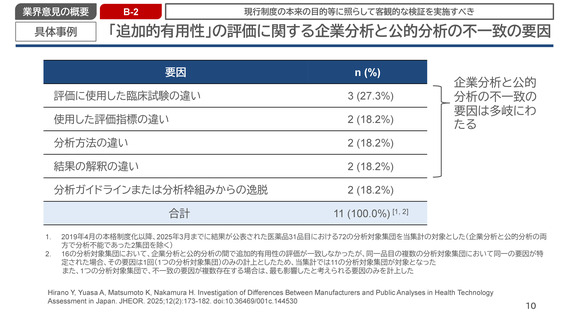
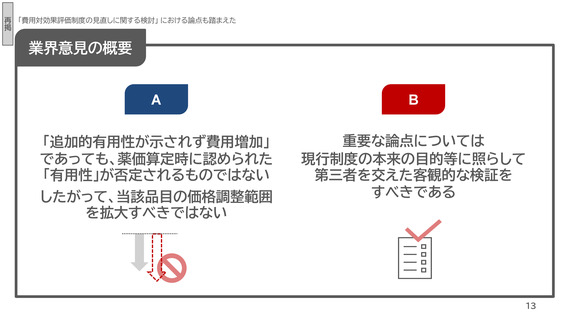
業界意見の概要
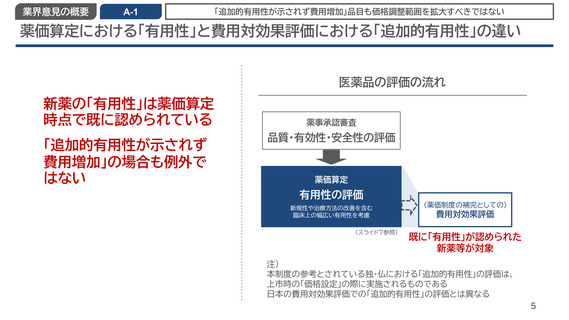
A-1
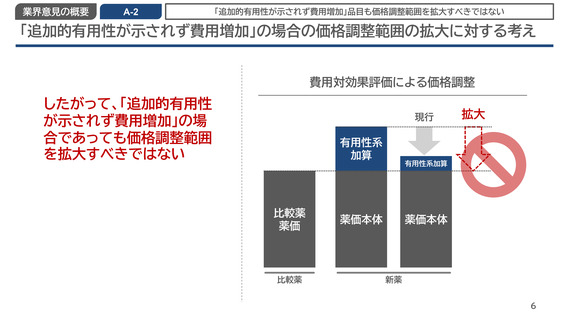
「追加的有用性が示されず費用増加」品目も価格調整範囲を拡大すべきではない
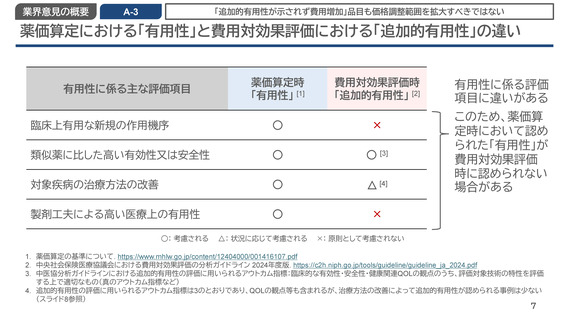
薬価算定における「有用性」と費用対効果評価における「追加的有用性」の違い
医薬品の評価の流れ
新薬の「有用性」は薬価算定
時点で既に認められている
「追加的有用性が示されず
費用増加」の場合も例外で
はない
薬事承認審査
品質・有効性・安全性の評価
薬価算定
有用性の評価
新規性や治療方法の改善を含む
臨床上の幅広い有用性を考慮
(スライド7参照)
(薬価制度の補完としての)
費用対効果評価
既に「有用性」が認められた
新薬等が対象
注)
本制度の参考とされている独・仏における「追加的有用性」の評価は、
上市時の「価格設定」の際に実施されるものである
日本の費用対効果評価での「追加的有用性」の評価とは異なる
5
A-1
「追加的有用性が示されず費用増加」品目も価格調整範囲を拡大すべきではない
薬価算定における「有用性」と費用対効果評価における「追加的有用性」の違い
医薬品の評価の流れ
新薬の「有用性」は薬価算定
時点で既に認められている
「追加的有用性が示されず
費用増加」の場合も例外で
はない
薬事承認審査
品質・有効性・安全性の評価
薬価算定
有用性の評価
新規性や治療方法の改善を含む
臨床上の幅広い有用性を考慮
(スライド7参照)
(薬価制度の補完としての)
費用対効果評価
既に「有用性」が認められた
新薬等が対象
注)
本制度の参考とされている独・仏における「追加的有用性」の評価は、
上市時の「価格設定」の際に実施されるものである
日本の費用対効果評価での「追加的有用性」の評価とは異なる
5