よむ、つかう、まなぶ。
費-1日本製薬団体連合会、日本製薬工業協会、米国研究製薬工業協会、欧州製薬団体連合会 (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_65756.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第74回 11/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
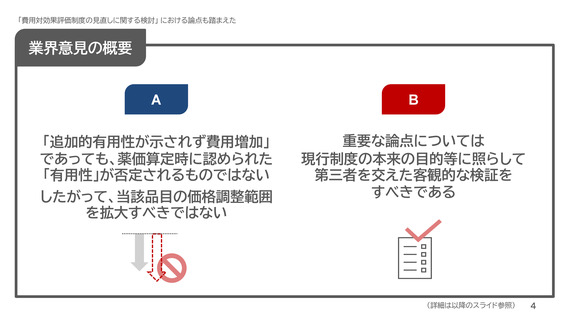
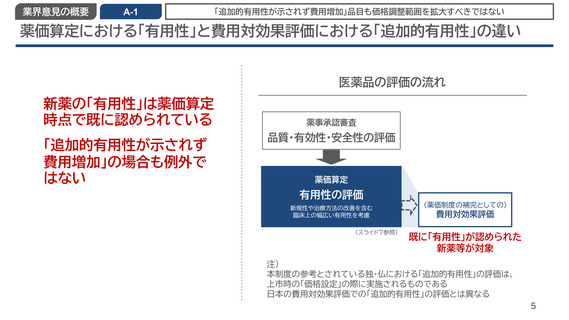
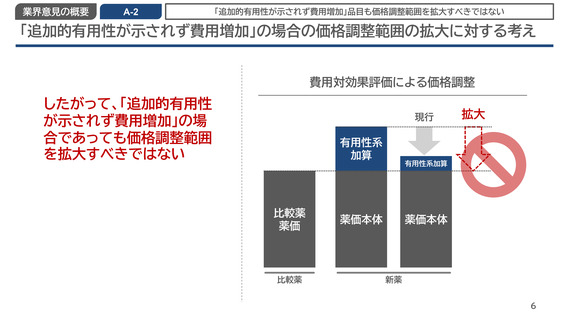
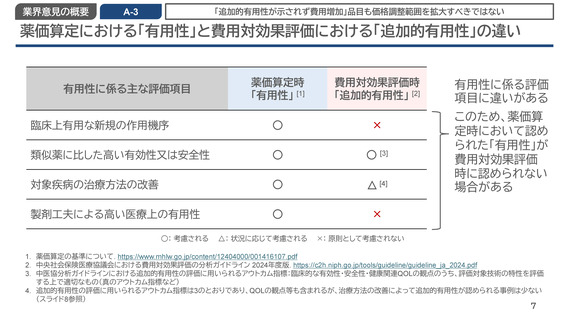
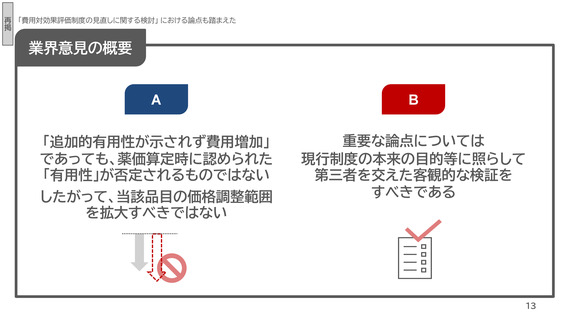
業界意見の概要
具体事例
B-2
現行制度の本来の目的等に照らして客観的な検証を実施すべき
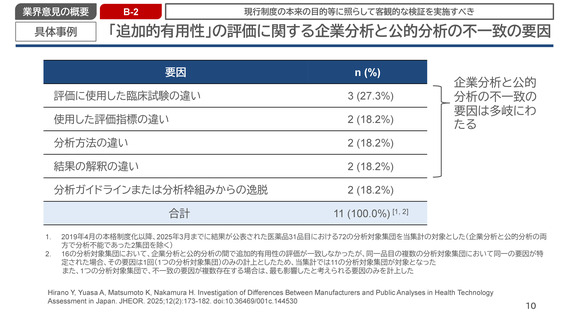
「追加的有用性」の評価に関する企業分析と公的分析の不一致の要因
要因
評価に使用した臨床試験の違い
3 (27.3%)
使用した評価指標の違い
2 (18.2%)
分析方法の違い
2 (18.2%)
結果の解釈の違い
2 (18.2%)
分析ガイドラインまたは分析枠組みからの逸脱
2 (18.2%)
合計
1.
2.
n (%)
企業分析と公的
分析の不一致の
要因は多岐にわ
たる
11 (100.0%) [1, 2]
2019年4月の本格制度化以降、2025年3月までに結果が公表された医薬品31品目における72の分析対象集団を当集計の対象とした(企業分析と公的分析の両
方で分析不能であった2集団を除く)
16の分析対象集団において、企業分析と公的分析の間で追加的有用性の評価が一致しなかったが、同一品目の複数の分析対象集団において同一の要因が特
定された場合、その要因は1回(1つの分析対象集団)のみの計上としたため、当集計では11の分析対象集団が対象となった
また、1つの分析対象集団で、不一致の要因が複数存在する場合は、最も影響したと考えられる要因のみを計上した
Hirano Y, Yuasa A, Matsumoto K, Nakamura H. Investigation of Differences Between Manufacturers and Public Analyses in Health Technology
Assessment in Japan. JHEOR. 2025;12(2):173-182. doi:10.36469/001c.144530
10
具体事例
B-2
現行制度の本来の目的等に照らして客観的な検証を実施すべき
「追加的有用性」の評価に関する企業分析と公的分析の不一致の要因
要因
評価に使用した臨床試験の違い
3 (27.3%)
使用した評価指標の違い
2 (18.2%)
分析方法の違い
2 (18.2%)
結果の解釈の違い
2 (18.2%)
分析ガイドラインまたは分析枠組みからの逸脱
2 (18.2%)
合計
1.
2.
n (%)
企業分析と公的
分析の不一致の
要因は多岐にわ
たる
11 (100.0%) [1, 2]
2019年4月の本格制度化以降、2025年3月までに結果が公表された医薬品31品目における72の分析対象集団を当集計の対象とした(企業分析と公的分析の両
方で分析不能であった2集団を除く)
16の分析対象集団において、企業分析と公的分析の間で追加的有用性の評価が一致しなかったが、同一品目の複数の分析対象集団において同一の要因が特
定された場合、その要因は1回(1つの分析対象集団)のみの計上としたため、当集計では11の分析対象集団が対象となった
また、1つの分析対象集団で、不一致の要因が複数存在する場合は、最も影響したと考えられる要因のみを計上した
Hirano Y, Yuasa A, Matsumoto K, Nakamura H. Investigation of Differences Between Manufacturers and Public Analyses in Health Technology
Assessment in Japan. JHEOR. 2025;12(2):173-182. doi:10.36469/001c.144530
10