よむ、つかう、まなぶ。
費薬材-1条件期限付き再生医療等製品の診療報酬上の算定方法の見直しについて (6 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_64496.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会・薬価専門部会・保険医療材料専門部会 合同部会(第20回 10/15)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
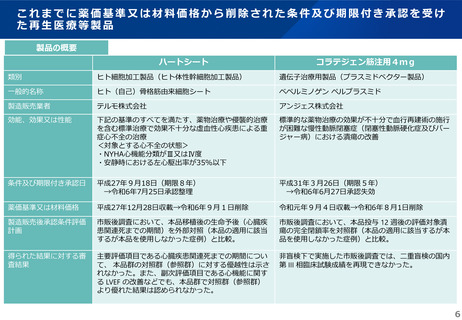
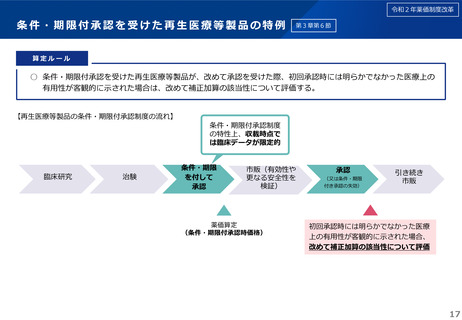
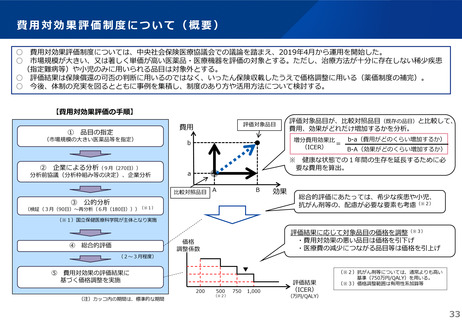
これまでに薬価基準又は材料価格から削除された条件及び期限付き承認を受け
た再生医療等製品
製品の概要
ハートシート
コラテジェン筋注用4mg
類別
ヒト細胞加工製品(ヒト体性幹細胞加工製品)
遺伝子治療用製品(プラスミドベクター製品)
一般的名称
ヒト(自己)骨格筋由来細胞シート
ベペルミノゲン ペルプラスミド
製造販売業者
テルモ株式会社
アンジェス株式会社
効能、効果又は性能
下記の基準のすべてを満たす、薬物治療や侵襲的治療
を含む標準治療で効果不十分な虚血性心疾患による重
症心不全の治療
<対象とする心不全の状態>
・NYHA心機能分類がⅢ又はⅣ度
・安静時における左心駆出率が35%以下
標準的な薬物治療の効果が不十分で血行再建術の施行
が困難な慢性動脈閉塞症(閉塞性動脈硬化症及びバー
ジャー病)における潰瘍の改善
条件及び期限付き承認日
平成27年9月18日(期限8年)
→令和6年7月25日承認整理
平成31年3月26日(期限5年)
→令和6年6月27日承認失効
薬価基準又は材料価格
平成27年12月28日収載→令和6年9月1日削除
令和元年9月4日収載→令和6年8月1日削除
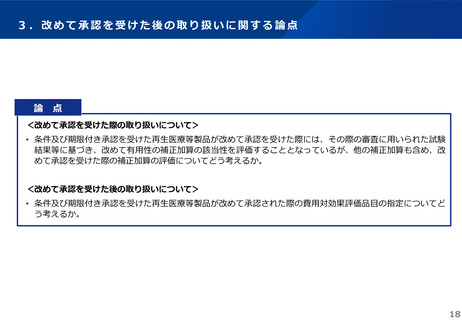
製造販売後承認条件評価
計画
市販後調査において、本品移植後の生命予後(心臓疾
患関連死までの期間)を外部対照(本品の適用に該当
するが本品を使用しなかった症例)と比較。
市販後調査において、本品投与 12 週後の評価対象潰
瘍の完全閉鎖率を対照群(本品の適用に該当するが本
品を使用しなかった症例)と比較。
得られた結果に対する審
査結果
主要評価項目である心臓疾患関連死までの期間につい
て、 本品群の対照群(参照群)に対する優越性は示さ
れなかった。また、副次評価項目である心機能に関す
る LVEF の改善などでも、本品群で対照群(参照群)
より優れた結果は認められなかった。
非盲検下で実施した市販後調査では、二重盲検の国内
第 III 相臨床試験成績を再現できなかった。
6
た再生医療等製品
製品の概要
ハートシート
コラテジェン筋注用4mg
類別
ヒト細胞加工製品(ヒト体性幹細胞加工製品)
遺伝子治療用製品(プラスミドベクター製品)
一般的名称
ヒト(自己)骨格筋由来細胞シート
ベペルミノゲン ペルプラスミド
製造販売業者
テルモ株式会社
アンジェス株式会社
効能、効果又は性能
下記の基準のすべてを満たす、薬物治療や侵襲的治療
を含む標準治療で効果不十分な虚血性心疾患による重
症心不全の治療
<対象とする心不全の状態>
・NYHA心機能分類がⅢ又はⅣ度
・安静時における左心駆出率が35%以下
標準的な薬物治療の効果が不十分で血行再建術の施行
が困難な慢性動脈閉塞症(閉塞性動脈硬化症及びバー
ジャー病)における潰瘍の改善
条件及び期限付き承認日
平成27年9月18日(期限8年)
→令和6年7月25日承認整理
平成31年3月26日(期限5年)
→令和6年6月27日承認失効
薬価基準又は材料価格
平成27年12月28日収載→令和6年9月1日削除
令和元年9月4日収載→令和6年8月1日削除
製造販売後承認条件評価
計画
市販後調査において、本品移植後の生命予後(心臓疾
患関連死までの期間)を外部対照(本品の適用に該当
するが本品を使用しなかった症例)と比較。
市販後調査において、本品投与 12 週後の評価対象潰
瘍の完全閉鎖率を対照群(本品の適用に該当するが本
品を使用しなかった症例)と比較。
得られた結果に対する審
査結果
主要評価項目である心臓疾患関連死までの期間につい
て、 本品群の対照群(参照群)に対する優越性は示さ
れなかった。また、副次評価項目である心機能に関す
る LVEF の改善などでも、本品群で対照群(参照群)
より優れた結果は認められなかった。
非盲検下で実施した市販後調査では、二重盲検の国内
第 III 相臨床試験成績を再現できなかった。
6