よむ、つかう、まなぶ。
総-2医薬品の新規薬価収載について (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_60772.html |
| 出典情報 | 中央社会保険医療協議会 総会(第614回 8/6)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
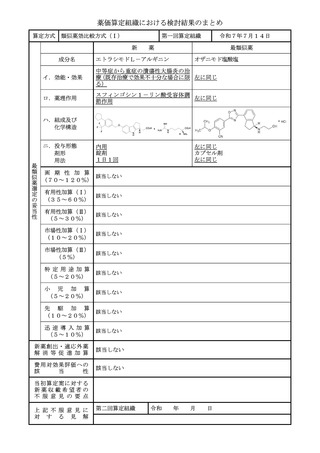
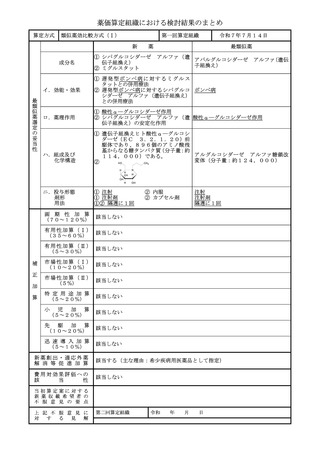
薬価算定組織における検討結果のまとめ
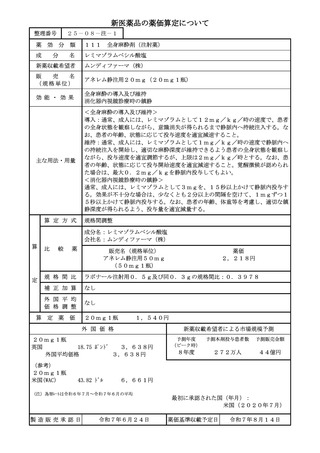
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
令和7年7月14日
薬
最類似薬
トアルクエタマブ(遺伝子組換え)
テクリスタマブ(遺伝子組換え)
イ.効能・効果
再発又は難治性の多発性骨髄腫(標準的
左に同じ
な治療が困難な場合に限る)
ロ.薬理作用
T 細胞依存性細胞傷害作用
ハ.組成及び
化学構造
445個のアミノ酸残基からなる抗G 448個のアミノ酸残基からなる抗BC
PRC5D-H鎖(γ4鎖)1本、21 MA-H鎖(γ4鎖)1本、214個の
4個のアミノ酸残基からなる抗GPR アミノ酸残基からなる抗BCMA-L鎖
C5D-L鎖(κ鎖)1本,452個の (λ鎖)1本、452個のアミノ酸残基
アミノ酸残基からなる抗CD3ε-H からなる抗CD3ε-H鎖(γ4鎖)1
鎖(γ4鎖)1本及び215個のアミノ 本及び215個のアミノ酸残基からなる
酸残基からなる抗CD3ε-L鎖(λ鎖) 抗CD3ε-L鎖(λ鎖)1本で構成さ
1本で構成される糖タンパク質(分子 れる糖タンパク質(分子量:約146,
量:約147,000)
000)
ニ.投与形態
剤形
用法
注射
注射剤
1週に1回又は2週に1回
画 期 性 加 算
(70~120%)
該当しない
左に同じ
左に同じ
左に同じ
1週に1回
該当する(A=35%)
〔イ.新規作用機序(異なる標的分子): ①-b=1p〕
〔ハ.治療方法の改善(不十分例): ③-a=1p〕
有用性加算(Ⅰ)
本剤はGPRC5D受容体を標的とする初めての二重特異性抗体であり、BCMA
(35~60%)
を標的とするCAR-T又は二重特異性抗体の前治療歴を有する再発又は難治性の
多発性骨髄腫患者を対象とした臨床試験においても臨床的意義のある効果が認めら
れていること等から、有用性加算(Ⅰ)(A=35%)を適用することが適当と判断
した。
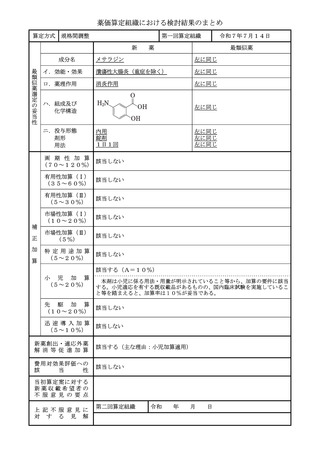
補
正
加
算
有用性加算(Ⅱ)
該当しない
(5~30%)
市場性加算(Ⅰ)
該当しない
(10~20%)
市場性加算(Ⅱ)
該当しない
(5%)
特 定 用 途 加 算
(5~20%)
小
該当しない
児 加 算
(5~20%)
該当しない
先 駆 加 算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当する(H1)
当初算定案に対する
新薬収載希望者の
不 服 意 見 の 要 点
上 記 不 服 意 見 に
対 す る 見 解
第二回算定組織
令和
15
年
月
日
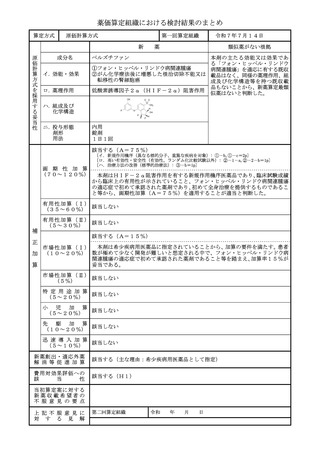
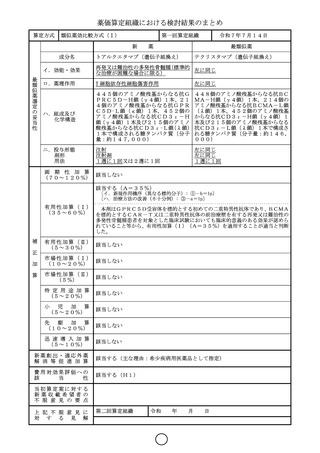
算定方式
類似薬効比較方式(Ⅰ)
第一回算定組織
新
成分名
最
類
似
薬
選
定
の
妥
当
性
令和7年7月14日
薬
最類似薬
トアルクエタマブ(遺伝子組換え)
テクリスタマブ(遺伝子組換え)
イ.効能・効果
再発又は難治性の多発性骨髄腫(標準的
左に同じ
な治療が困難な場合に限る)
ロ.薬理作用
T 細胞依存性細胞傷害作用
ハ.組成及び
化学構造
445個のアミノ酸残基からなる抗G 448個のアミノ酸残基からなる抗BC
PRC5D-H鎖(γ4鎖)1本、21 MA-H鎖(γ4鎖)1本、214個の
4個のアミノ酸残基からなる抗GPR アミノ酸残基からなる抗BCMA-L鎖
C5D-L鎖(κ鎖)1本,452個の (λ鎖)1本、452個のアミノ酸残基
アミノ酸残基からなる抗CD3ε-H からなる抗CD3ε-H鎖(γ4鎖)1
鎖(γ4鎖)1本及び215個のアミノ 本及び215個のアミノ酸残基からなる
酸残基からなる抗CD3ε-L鎖(λ鎖) 抗CD3ε-L鎖(λ鎖)1本で構成さ
1本で構成される糖タンパク質(分子 れる糖タンパク質(分子量:約146,
量:約147,000)
000)
ニ.投与形態
剤形
用法
注射
注射剤
1週に1回又は2週に1回
画 期 性 加 算
(70~120%)
該当しない
左に同じ
左に同じ
左に同じ
1週に1回
該当する(A=35%)
〔イ.新規作用機序(異なる標的分子): ①-b=1p〕
〔ハ.治療方法の改善(不十分例): ③-a=1p〕
有用性加算(Ⅰ)
本剤はGPRC5D受容体を標的とする初めての二重特異性抗体であり、BCMA
(35~60%)
を標的とするCAR-T又は二重特異性抗体の前治療歴を有する再発又は難治性の
多発性骨髄腫患者を対象とした臨床試験においても臨床的意義のある効果が認めら
れていること等から、有用性加算(Ⅰ)(A=35%)を適用することが適当と判断
した。
補
正
加
算
有用性加算(Ⅱ)
該当しない
(5~30%)
市場性加算(Ⅰ)
該当しない
(10~20%)
市場性加算(Ⅱ)
該当しない
(5%)
特 定 用 途 加 算
(5~20%)
小
該当しない
児 加 算
(5~20%)
該当しない
先 駆 加 算
(10~20%)
該当しない
迅 速 導 入 加 算
(5~10%)
該当しない
新薬創出・適応外薬
解 消 等 促 進 加 算
該当する(主な理由:希少疾病用医薬品として指定)
費用対効果評価への
該
当
性
該当する(H1)
当初算定案に対する
新薬収載希望者の
不 服 意 見 の 要 点
上 記 不 服 意 見 に
対 す る 見 解
第二回算定組織
令和
15
年
月
日