参考資料3-2:人を対象とする生命科学・医学系研究に関する倫理指針 ガイダンス (70 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_57354.html |
| 出典情報 | 生命科学・医学系研究等における個人情報の取扱い等に関する合同会議(第10回 4/24)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
電磁的方法によりインフォームド・コンセントを受ける場合には、当該電磁的方法による
説明及び同意の方法・説明内容(第8の5の規定による説明事項を記載した電子文書及び
同意様式の使用を想定している場合は当該様式を含む。)を記載した資料を、オプトアウ
トによる場合には、通知し、又は研究対象者等が容易に知り得る状態に置く文書の見本な
どを研究計画書に添付し、倫理審査委員会における審査に提供する必要がある。
6
⑦の規定に関して、共同研究機関、試料・情報の提供のみを行う機関と試料・情報の授
受を行う予定がある場合においては、第8の3に規定する「試料・情報の提供に関する記
録」を作成する方法(作成する時期、記録の媒体、作成する研究者等の氏名、別に作成す
る書類による代用の有無等)及び保管する方法(場所、第8の3の解説に記載する提供元
の機関における記録の保管の代行等)を含めて記載する必要がある(試料・情報の授受が
多数となる場合は別添として整理してもよい。)。また、第8の1⑴に規定する研究機関が
講じたインフォームド・コンセントの内容等を研究協力機関が確認する方法及び第8の1
⑸に規定する提供先の機関が試料・情報の提供を受けた際に提供元の機関で講じたインフ
ォームド・コンセントの内容等を確認する方法についても、併せて記載することが望まし
い。
なお、「試料・情報の提供に関する記録」に係る必要事項を研究計画書に記載している
場合は、当該研究計画書それ自体を保管することをもって当該記録に関する義務の一部を
満たすことができる。この場合、研究計画の中で実施される全ての試料・情報の授受ごと
に提供元の機関と提供先の機関を特定して研究計画書に記載する必要はなく、一連の試
料・情報の授受の内容について、事後的に追跡できるように必要な範囲で記載されていれ
ばよい。詳細については第8の3の解説を参照。
7
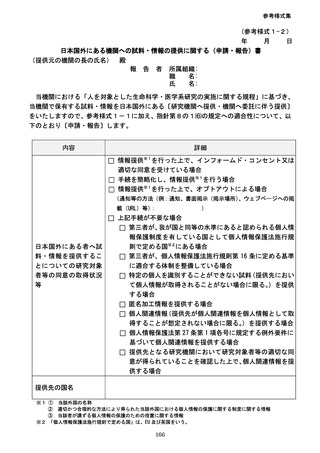
⑦の規定に関して、外国にある者へ試料・情報の提供を行う予定がある場合(委託によ
り提供する場合を含む。)においては、第8の1⑹の規定に沿って手続を行う必要がある
ため、その手続の内容(以下の事項を含む。)を含めて記載する必要がある。なお、
「外国」
の考え方については、第8の1⑹アの解説を参照。
・ 第8の1⑹イに基づいて提供する情報の内容
・ 提供先が個人情報保護法施行規則第 16 条に定める基準に適合する体制を整備して
いることを根拠として提供する場合にはその旨及び第8の1⑹ウに基づき講ずる必
要な措置の内容
8
⑧の「個人情報等の取扱い」に関し、第 18 の1の規定により個人情報等の安全管理の
ために講じる措置の内容についても記載する必要がある(なお、安全管理措置については、
個人情報等の取扱状況(取り扱う個人情報等の性質及び量を含む。)等に起因するリスク
に応じて、必要かつ適切な内容とする必要がある。)。
共同研究の場合は、研究に用いられる情報の個人情報等の該当性の判断は各機関で行う
こととなるが、研究計画書の作成に際して、関係する研究機関と事前に調整を行うことが
必要であり、この中で個人情報等の取扱いについても必要に応じて調整することとする。
67