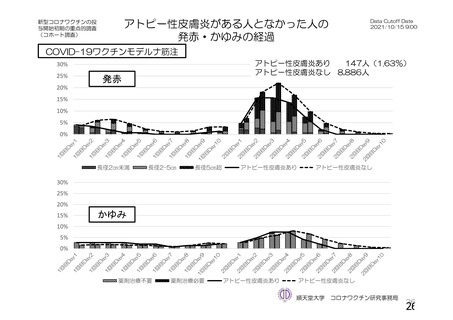
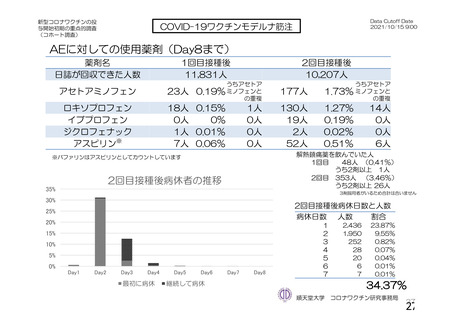
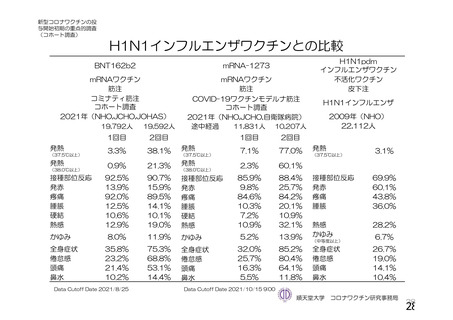
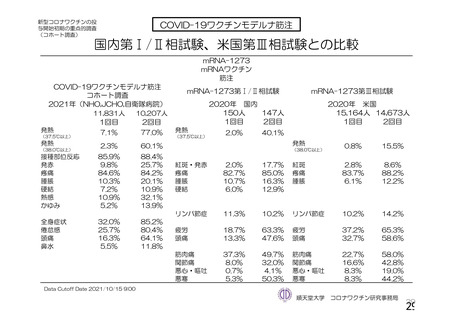
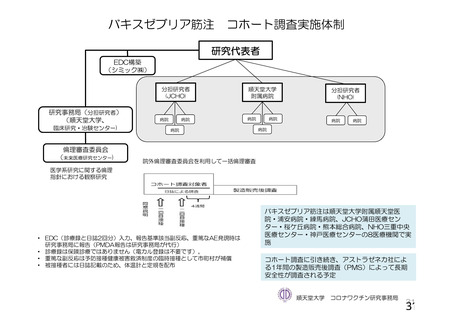
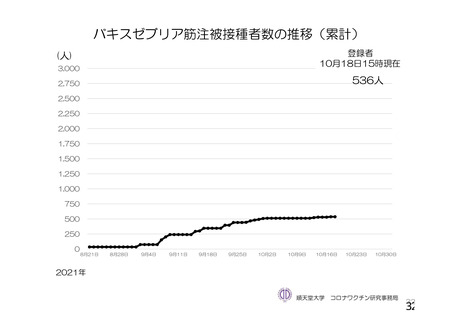
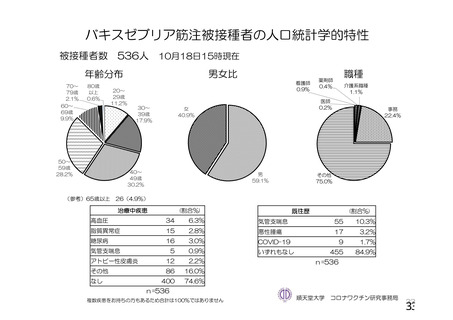
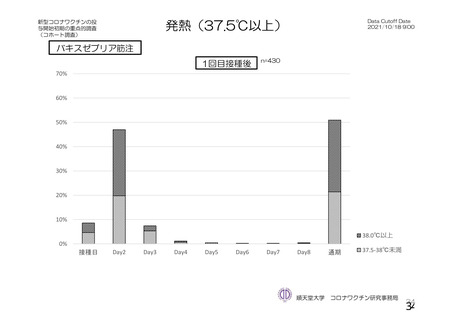
参考資料1-2 浜口班の議論における参考資料(令和3年10月25日開催) (91 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
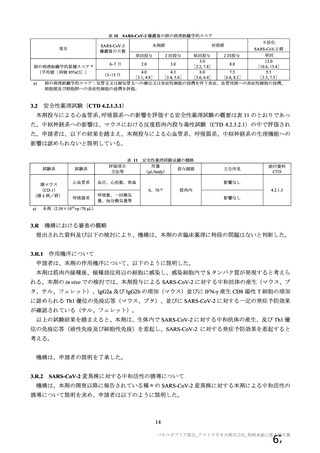
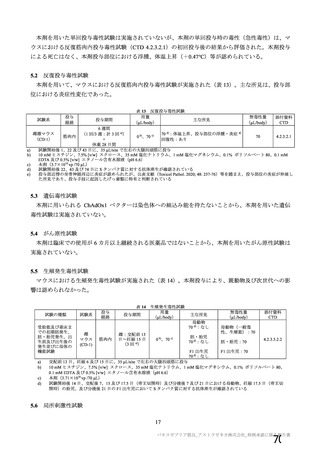
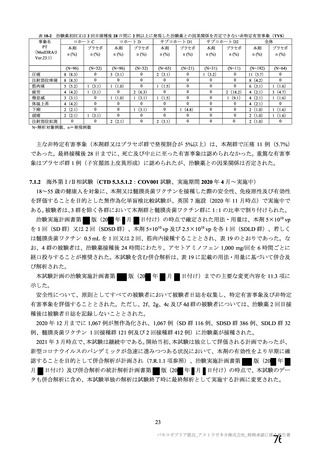
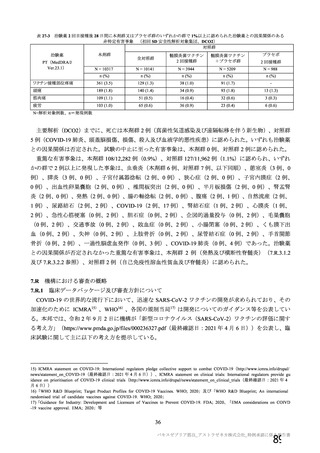
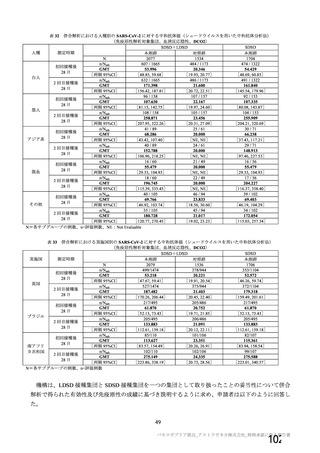
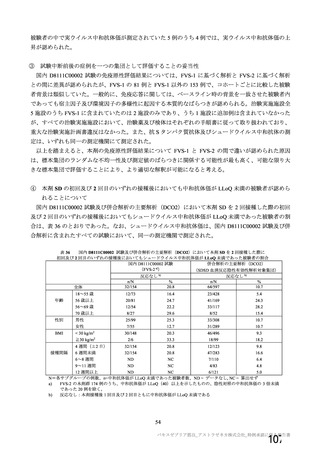
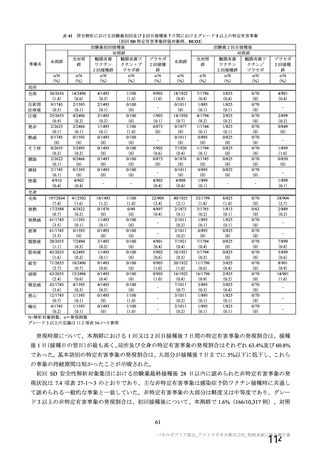
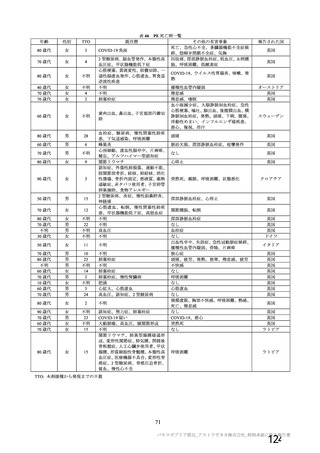
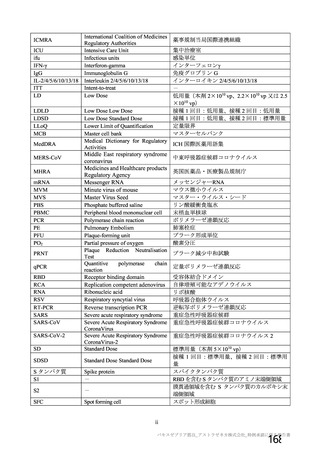
試験名
実施国
試験開始日
実施状況
開発相
試験デザイン
目標例数
併合解析に含めた
被験者の年齢
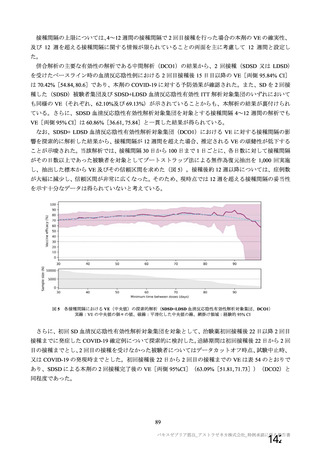
COV001 試験 a)
英国
2020 年 4 月
実施中
Ⅰ/Ⅱ
単盲検無作為化比較
試験
約 1090 例
18~55 歳
併合解析を行った海外 4 試験の概要
COV002 試験 b)
英国
2020 年 5 月
実施中
Ⅱ/Ⅲ
単盲検無作為化比較
試験
約 12390 例
18 歳以上
COV003 試験 c)
ブラジル
2020 年 6 月
実施中
Ⅲ
単盲検無作為化比較
試験
約 10300 例
18 歳以上
COV005 試験 d)
南アフリカ共和国
2020 年 6 月
実施中
Ⅰ/Ⅱ
二重盲検無作為化比較試験
約 2070 例
18~65 歳
健康成人
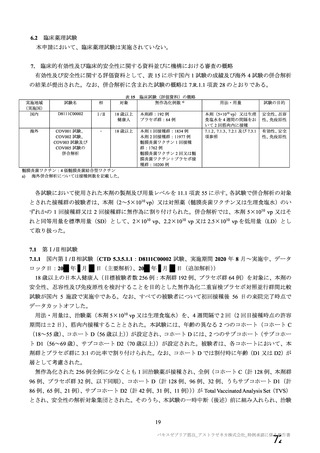
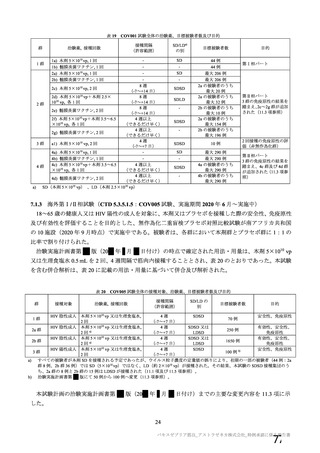
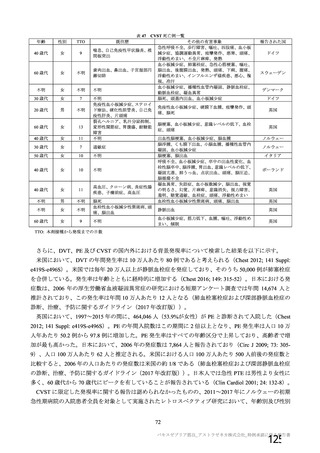
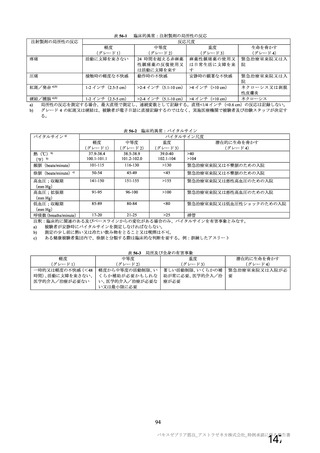
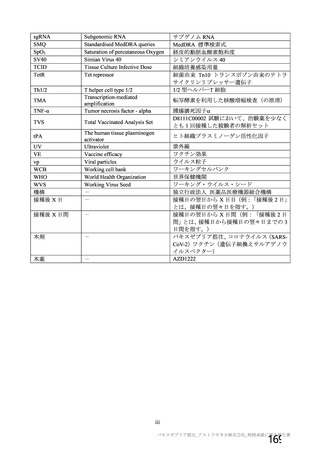
対象者
主な背景疾患/状態に関
する除外基準
成人(医療従事者及び 成人(医療従事者及び HIV 感染又は非感染の成人
SARS-CoV-2 に 曝 露 SARS-CoV-2 に 曝 露
している可能性が高 している可能性が高
い成人を優先)
い成人を優先)
・基礎疾患等のある ・重度及びコントロールされていない基礎疾患/病態のある者
者
・確定診断された免疫抑制又は免疫不全状態若しくはその疑いのある者
・アナフィラキシー、 ・アナフィラキシー、血管浮腫の既往
血管浮腫の既往
・本剤又は髄膜炎菌ワクチンの成分によって悪化するようなアレルギー疾患
・本剤又は髄膜炎菌 又はアレルギー反応の既往
ワクチンの成分に
よって悪化するよう
なアレルギー疾患又
はアレルギー反応の
既往
妊婦、授乳婦又は試験期
間内に妊娠を計画/希望
する者の取扱い
COVID-19 に関連する
除外基準
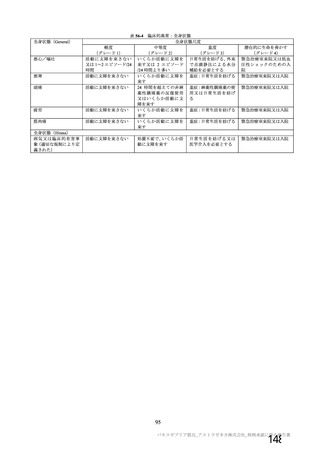
治験薬の接種回数
(筋注)
本剤の用量
組入れから除外された
・検査で確定された
COVID-19 の既往
・2020 年 2 月以降に
発熱、咳嗽、息切れ等
を 認 め た 者 又 は
SARS-CoV-2 抗 体 陽
性
・組入れ前に COVID19 患者と接触リスク
の高い者
・COVID-19 の重症化
リスクの高い者と同
居している
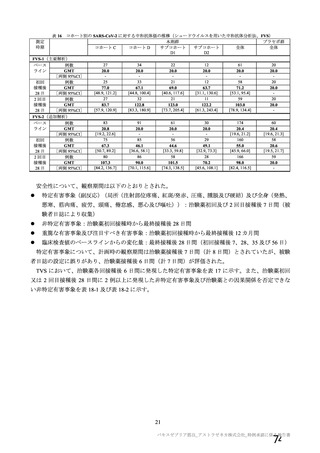
1 回又は 2 回
(試験群に基づく)
SD:5×1010 vp
LD:2.5×1010 vp
髄膜炎菌ワクチン
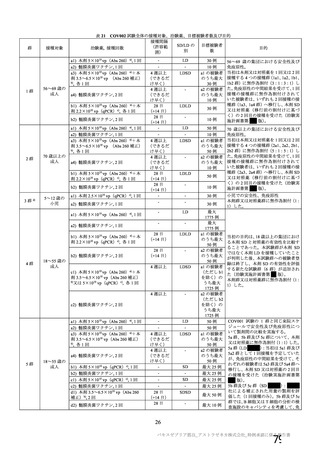
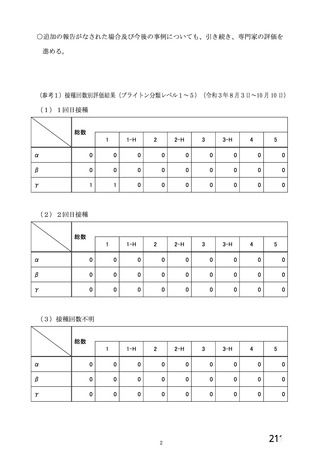
・検査で確定された
COVID-19 の 既 往
(5d、9、10 及び 11 群
を除く)
・検査で確定された
COVID-19 の既往(血
清学的、抗原又は抗体
に基づく迅速検査、又
は核酸増幅検査)
・リクルート前の
SARS-CoV-2 抗 体 陽
性(治験実施計画書第
版以降は適用され
ない)
・無作為化前の 96 時間以内
に分子学的検査で最近の
SARS-CoV-2 感染が確定され
た
・検査で確定された COVID19 の既往又は SARS-CoV-2
感染者との濃厚接触(同居
等)
・スクリーニング/登録前
30 日以内に発熱、咳嗽、息切
れの新規発現を認めた者
1 回又は 2 回
(試験群に基づく)
SD:5×1010 vp
LD:2.2×1010 vp
髄膜炎菌ワクチン
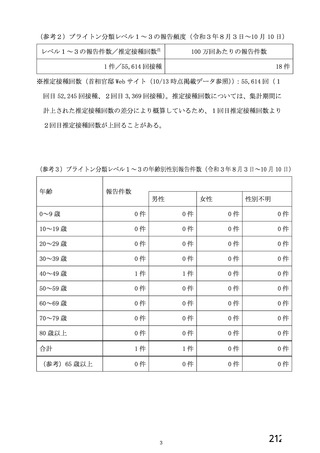
2回
2回
SD:5×1010 vp
SD:5×1010 vp
LD:2×1010 vp
プラセボ
(生理食塩水)
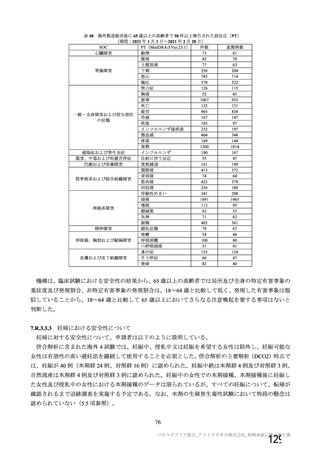
4~8 週間
受動的
4 週間以上
受動的及び能動的(週
1 回の鼻腔ぬぐい液
検体又は唾液検体の
SARS-CoV-2 の 核 酸
増幅検査)
・一部の被験者での
被験者日誌
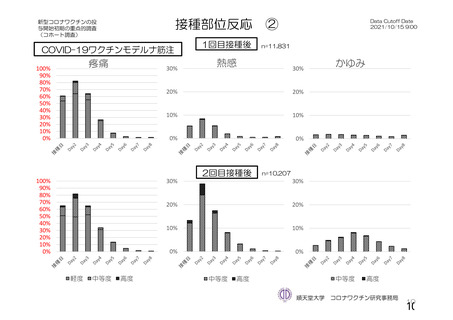
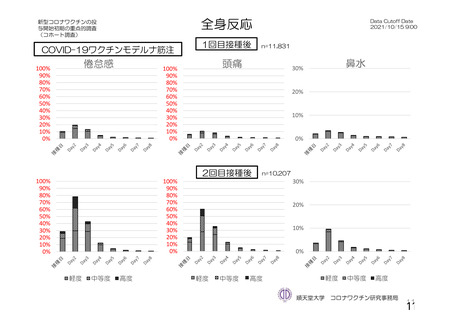
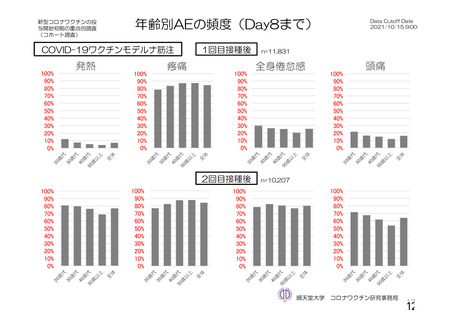
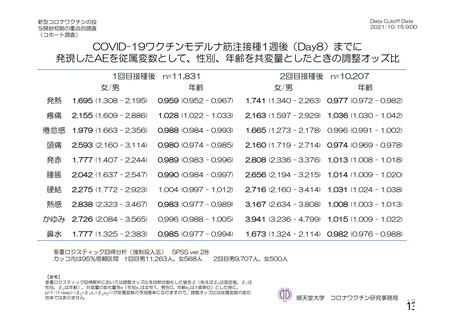
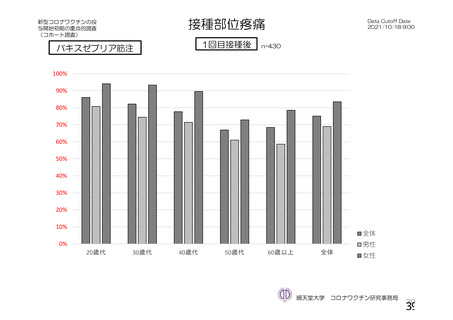
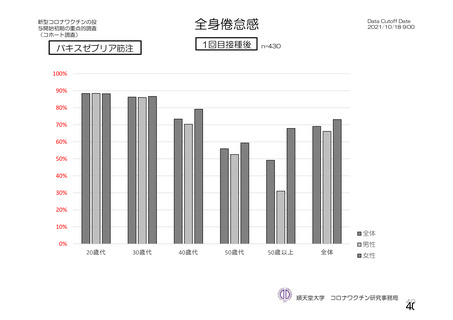
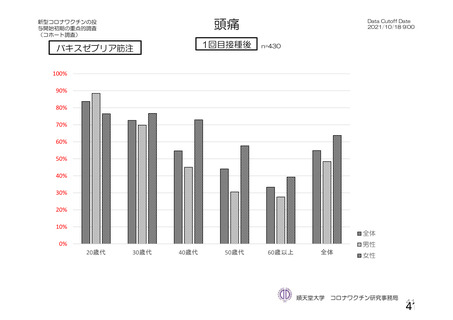
・収集期間:各回接種
後 7 日間(Day 0~7)
・7 種の局所事象及び
10 種の全身事象につ
いて COV 001 試験と
同一
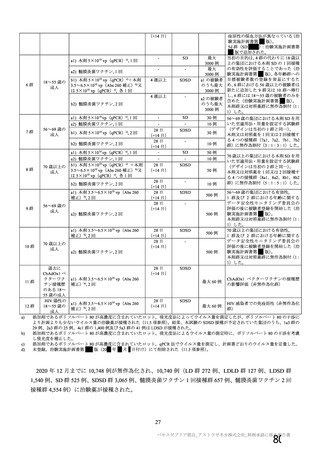
対照薬
接種間隔の設定
COVID-19 発症例の
検出方法
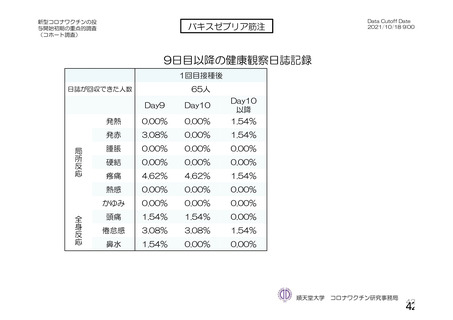
安全性情報
の収集方法
特定有害
事象
・一部の被験者での
被験者日誌
・収集期間:各回接種
後 7 日間(Day 0~7)
・7 種の局所事象及び
10 種の全身事象につ
いて COV 002 試験と
同一
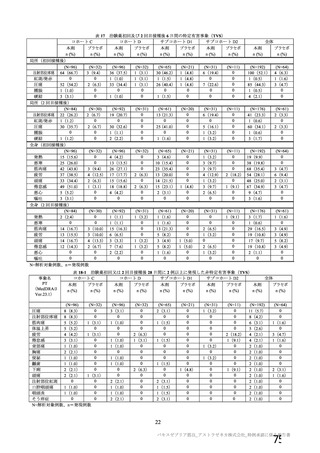
初回:髄膜炎菌ワク
チン
2 回目:プラセボ
(生理食塩水)
4~12 週間
受動的
・一部の被験者での
被験者日誌
・収集期間:各回接種
後 7 日間(Day 0~7)
・7 種の局所事象及び
10 種の全身事象につ
いて COV 001 試験及
び COV 002 試験と同
義語を用いた
4 週間
受動的及び能動的(来院によ
る鼻腔ぬぐい液検体又は唾
液検体の SARS-CoV-2 の核
酸増幅検査)
・一部の被験者での被験者日
誌
・収集期間:各回接種後 6 日
間(Day 0~6)
・5 種の局所事象及び 7 種の
全身事象について COV001
試験及び COV002 試験と同
一又は同義語を使用したが、
一部の事象(疼痛、熱感、倦
怠感、悪心、嘔吐)は被験者
38
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
91