参考資料1-2 浜口班の議論における参考資料(令和3年10月25日開催) (158 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
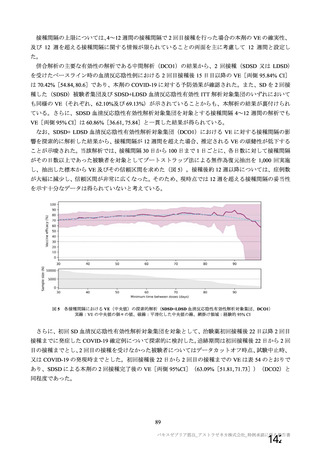
できる。
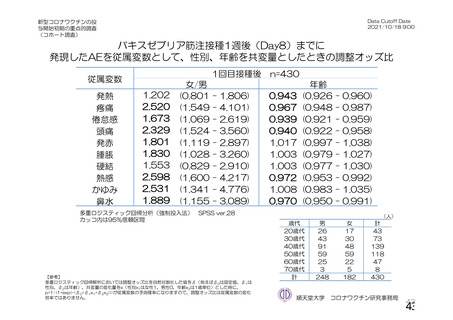
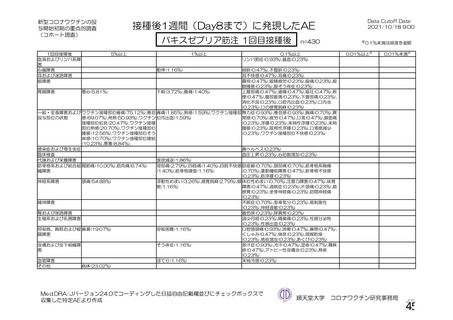
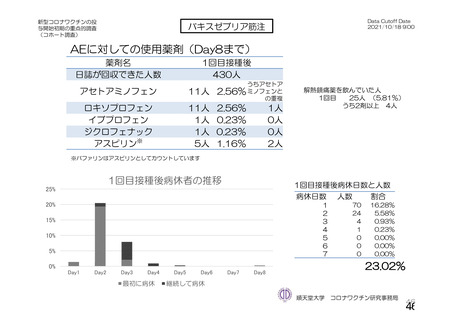
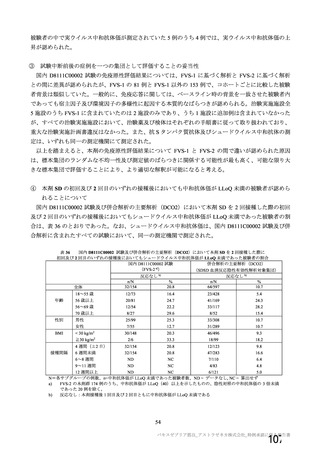
本剤接種後の血栓性イベントは、基本的に 10 万人に 1 人程度に発生する非常にまれなイベントで
あると考えるので、日本人で前向きに検討した結果をもとに注意喚起を行うことは困難と考える。
製造販売後の情報収集・評価では、日本の既存のデータベース利用と併せて、海外データベースの
積極的な利用を検討してほしい。
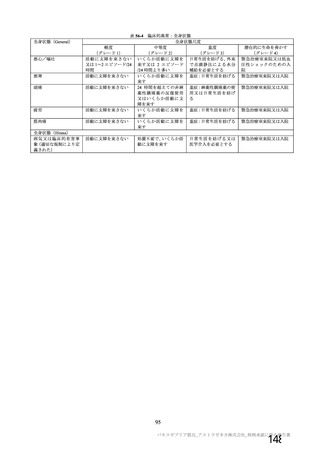
本剤接種後の血栓性イベントに関する医療従事者への情報提供、及び診断・治療指針の作成について、
機構より、既に一部の学会から診断・治療指針の作成について前向きにご協力いただけると聞いており、
今後厚生労働省及び申請者とも連携の上、遅滞なく広範な情報共有及び当該指針の円滑な運用に努めた
い旨説明し、機構の判断は専門委員により支持された。
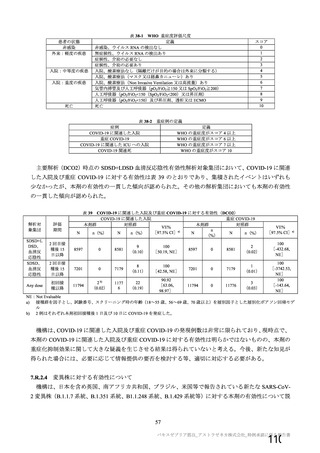
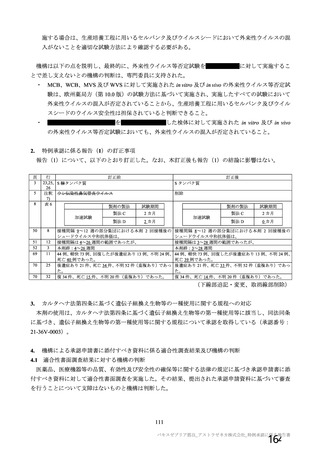
重大な副反応の事象名として「血小板減少症を伴う血栓症」ではなく「血栓症」とすることが適切で
あるとした機構の判断について議論がなされ、専門委員より、本剤接種と関わりなく一定数の血栓症は
起こるものと考えられるが、広く「血栓症」と注意喚起することにより、本剤接種後に起きたすべての
血栓症が本剤に起因するものとされる可能性を懸念する旨の意見が出された。機構は、医薬品リスク管
理計画上は重要な特定されたリスクとして「血小板減少症を伴う血栓症」を、重要な潜在的リスクとし
て「血栓症」をそれぞれ設定する旨、並びに添付文書の重大な副反応においては「血栓症」として注意
喚起した上で、本剤接種後に重篤な血小板減少症を伴う血栓症が認められること及び CVST 等の極めて
まれな血栓症が認められることを情報提供する旨を説明し、最終的に機構の判断は専門委員により支持
された。
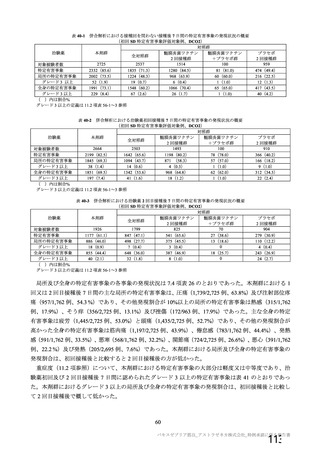
現時点では本剤の承認に性別、年齢等の特段の制限を設けることは適切でないとした機構の判断につ
いて、機構は、本剤の実運用にあたっては、公的ワクチン接種プログラムの中でその時点の SARS-CoV2 流行状況等も踏まえてより適切な接種対象が設定される可能性が高いと考えており、その際には、本
審査における内容も考慮されると考えることから、専門協議で出された意見を適切に共有して実運用に
生かしたい旨説明し、最終的に機構の判断は専門委員により支持された。
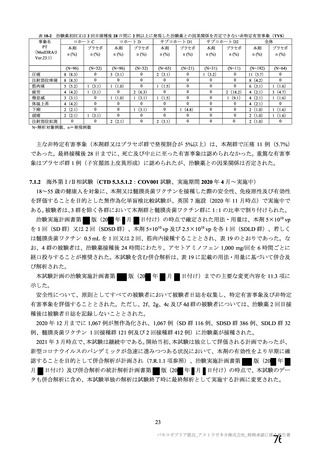
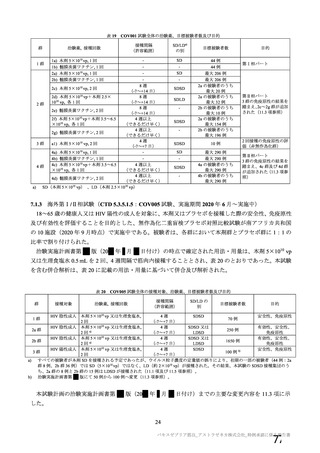
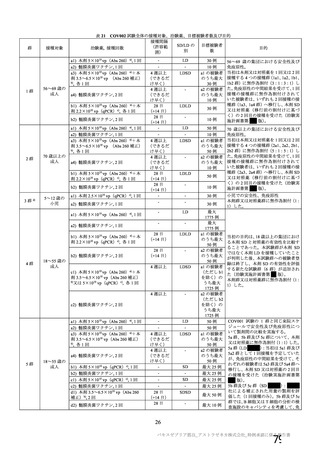
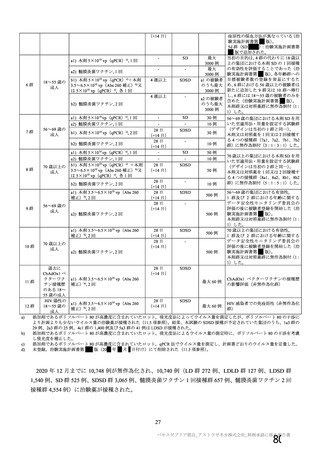
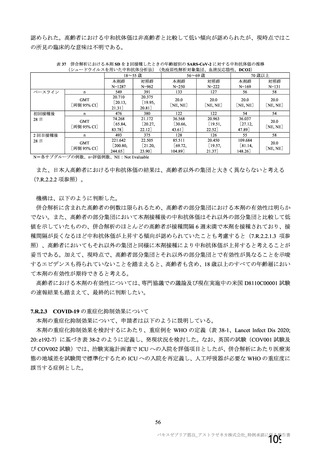
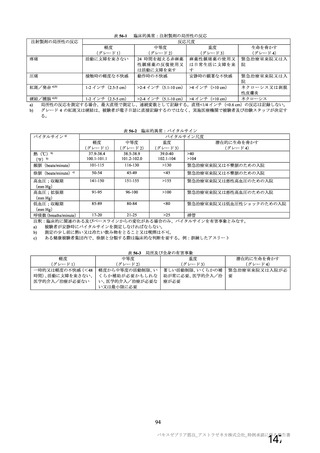
製造販売後の調査について、機構より、基本的にはワクチン接種はレセプト上に記録されず、また、
ワクチン接種情報が医療機関の電子診療録に記録される症例は限られること、並びに COVID-19 発症例
及び死亡例と本剤接種後の血栓性イベントの発現例及び転帰死亡例を比較するためには 100 万人規模の
データベースが必要であることから、本邦においてデータベースを用いた適切な調査は困難であるとの
説明が申請者から得られている旨を説明した。加えて、機構としても別途データベース調査の実施可能
性を検討したが、現状では、ワクチン接種に関する情報は各地方自治体が所有しており、当該接種情報
と既存のデータベースとの情報の関連付けができないことや各医療機関の電子診療録のシステムによっ
てはワクチン接種情報を記録できないこと等から、本事象について国内で大規模データベースを用いた
調査検討を行うことは困難である旨を説明した。これに対して専門委員より、大規模なデータベースに
基づく調査等の実施については行政主導で考えてほしいとの意見、従来から感染症予防ワクチンの接種
情報と有害事象情報等との関連付けの重要性については学会等からも指摘してきたところであるとの意
見、個人の健康情報との紐付けに関しては厚生労働省だけでなく関係省庁を巻き込むことも必要である
との意見等が出された。機構より、国内では各学会の協力も得た上で製造販売後における副反応情報収
集(患者の背景情報や検査データを含む)、評価及びフィードバックを行う体制を適切に構築する旨、
及び公的プログラムにおいて接種される本剤については接種者の母数が把握可能であり、製造販売後の
105
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
158