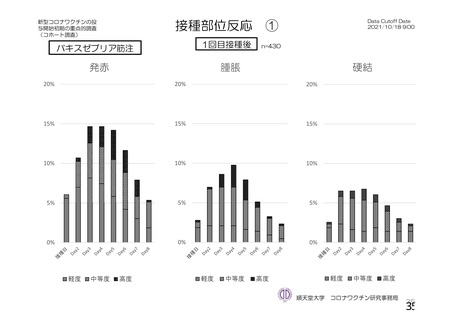
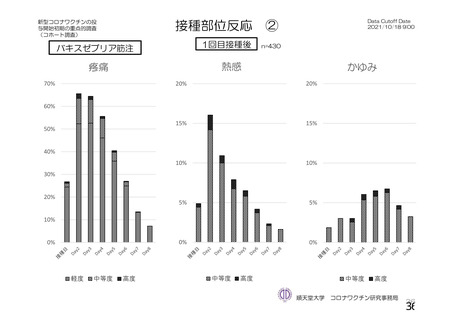
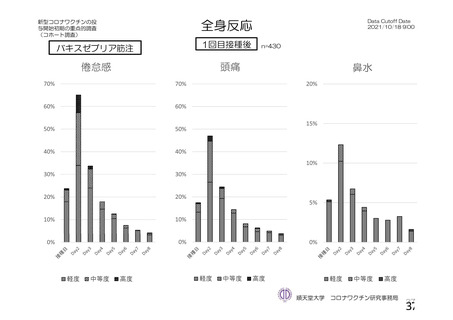
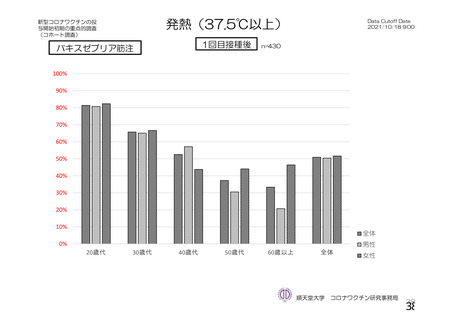
参考資料1-2 浜口班の議論における参考資料(令和3年10月25日開催) (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24719.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会血液事業部会安全技術調査会(令和3年度第6回 3/29)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
情報を収集し、報告すること。
(2) 第 2 号関係
本剤の使用によるものと疑われる疾病、障害又は死亡の発生を知ったときは、速やかに報告
すること。
(3)
第 3 号関係
本剤が特例承認を受けたものであること及び当該承認の趣旨が、本剤を使用する医療関係者
に理解され、適切に被接種者又は代諾者に説明できるために必要な措置を講じること。
(4) 第 4 号関係
本剤の販売数量又は授与数量を必要に応じて報告すること。
2.
本剤は、承認に当たり医薬品医療機器等法第 79 条第 1 項の規定に基づき、以下の条件を付したこ
と。
(1) 医薬品リスク管理計画を策定の上、適切に実施すること。
(2) 現時点での知見が限られていることから、製造販売後、副反応情報等の本剤の安全性に関す
るデータを、あらかじめ定めた計画に基づき早期に収集するとともに、独立行政法人医薬品
医療機器総合機構に提出し、本剤の適正使用に必要な措置を講じること。その際、国が実施
する健康調査等により得られた情報についても適切に反映すること。
(3) 現在国内外で実施中又は計画中の臨床試験の成績が得られた際には、速やかに当該成績を独
立行政法人医薬品医療機器総合機構に提出するとともに、本剤の有効性及び安全性に係る最
新の情報を、医療従事者及び被接種者が容易に入手可能となるよう必要な措置を講じること。
また、国が行う本剤の有効性及び安全性に係る情報の発信について、適切に協力すること。
(4) 本剤は、医薬品医療機器等法第 14 条の 3 第 1 項の規定に基づき承認された特例承認品目で
あり、承認時において長期安定性等に係る情報は限られているため、製造販売後も引き続き
情報を収集し、報告すること。
(5) 本剤の接種に際し、本剤の有効性及び安全性については今後も情報が集積されることを踏ま
え、あらかじめ被接種者又は代諾者に最新の有効性及び安全性に関する情報が文書をもって
説明され、予診票等で文書による同意を得てから接種されるよう、医師に対して適切に説明
すること。
(6) 医薬品医療機器等法施行規則第 41 条に基づく資料の提出の猶予期間は、承認取得から起算
して 6 カ月とする。上記に基づいて提出された資料等により、承認事項を変更する必要が認
められた場合には、医薬品医療機器等法第 74 条の 2 第 3 項に基づき承認事項の変更を命ず
ることがあること。
3.
本剤は、医薬品医療機器等法第 14 条の 3 第 1 項に基づく承認であるため、同法第 75 条の 3 の規
定により、同法第 14 条の 3 第 1 項各号のいずれかに該当しなくなったと認めるとき、又は保健衛
生上の危害の発生若しくは拡大を防止するため必要があると認めるときは、これらの承認を取り
消すことがあること。
2
バキスゼブリア筋注_アストラゼネカ株式会社_特例承認に係る報告書
53