よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
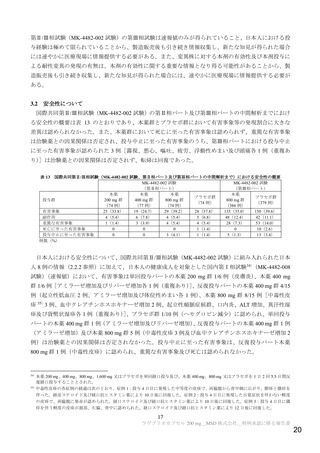
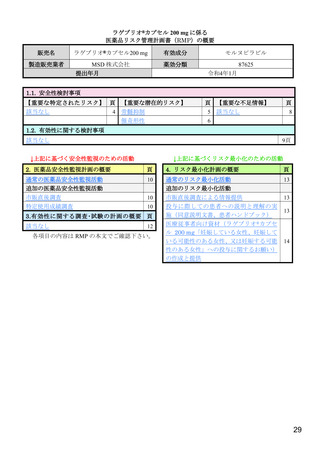
表2
治験薬投与開始時点から RT-PCR 結果が陰性となった検体採取日までの時間(鼻咽頭ぬぐい検体)(MITT 集団)
本薬 200 mg 群
本薬 400 mg 群
本薬 800 mg 群
プラセボ群
(23 例)
(61 例)
(53 例)
(61 例)
21
48
49
49
イベント数 a)
中央値[95%信頼区間]
(日)
22.0[15.0, 28.0]
27.0[15.0, 28.0]
14.0[13.0, 14.0]
15.0[15.0, 27.0]
a)2 回連続で RT-PCR 検査結果が陰性の場合にイベント発現とされ、イベント発現日は 1 回目に RT-PCR 検査結果が陰性となった検
体の採取日とされた。なお、最後に採取された検体においてのみ RT-PCR 検査結果が陰性であった場合には、最後の採取時点がイ
ベント発現日とされた。
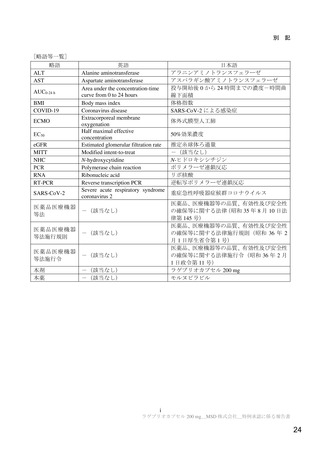
図1
RT-PCR 検査結果が陰性となった検体採取日までの時間の Kaplan-Meier 曲線(鼻咽頭ぬぐい検体)(MITT 集団)
安全性10)について、有害事象及び副作用11)は、本薬 200 mg 群で 47.8%(11/23 例)及び 17.4%(4/23
例)、本薬 400 mg 群で 32.3%(20/62 例)及び 21.0%(13/62 例)、本薬 800 mg 群で 20.0%(11/55 例)
及び 1.8%(1/55 例)、プラセボ群で 29.0%(18/62 例)及び 12.9%(8/62 例)に認められた。いずれかの
群で 2 例以上に認められた有害事象及び副作用の発現状況は表 3 のとおりであった。
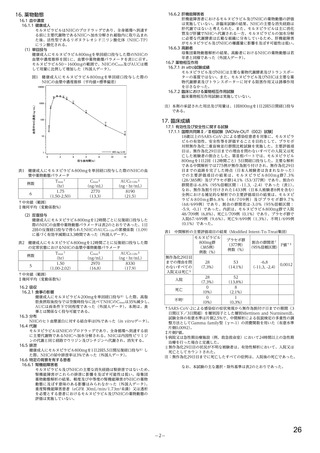
表3
いずれかの群で 2 例以上に認められた有害事象及び副作用(安全性解析対象集団)
有害事象
副作用
本薬
本薬
本薬
本薬
本薬
本薬
事象名
プラセボ群
200 mg 群
400 mg 群
800 mg 群
200 mg 群
400 mg 群
800 mg 群
(62 例)
(23 例)
(62 例)
(55 例)
(23 例)
(62 例)
(55 例)
全体
11(47.8) 20(32.3) 11(20.0) 18(29.0)
4(17.4)
13(21.0)
1(1.8)
0
0
頭痛
1(4.3)
3(4.8)
2(3.6)
3(4.8)
2(3.2)
0
0
0
0
浮動性めまい
2(8.7)
1(1.6)
1(4.3)
0
0
0
0
0
0
錯感覚
2(3.2)
0
0
ALT 増加
2(3.2)
2(3.6)
2(3.2)
2(3.2)
1(1.8)
0
0
AST 増加
1(1.6)
2(3.6)
1(1.6)
1(1.6)
1(1.8)
0
0
0
0
0
血中クレアチニン増加
3(4.8)
3(4.8)
0
0
悪心
1(4.3)
2(3.2)
1(1.6)
1(4.3)
2(3.2)
0
0
0
0
0
腹痛
1(1.6)
2(3.2)
0
0
0
0
0
咳嗽
2(3.2)
1(1.8)
0
不眠症
2(8.7)
1(1.6)
1(1.8)
4(6.5)
2(8.7)
1(1.6)
例数(%)、MedDRA ver.23.0
10)
11)
プラセボ群
(62 例)
8(12.9)
0
0
0
2(3.2)
1(1.6)
0
1(1.6)
1(1.6)
0
3(4.8)
治験薬投与終了 14 日後までに認められた有害事象及び副作用
治験責任医師等により治験薬との因果関係ありと評価された有害事象
5
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
8
治験薬投与開始時点から RT-PCR 結果が陰性となった検体採取日までの時間(鼻咽頭ぬぐい検体)(MITT 集団)
本薬 200 mg 群
本薬 400 mg 群
本薬 800 mg 群
プラセボ群
(23 例)
(61 例)
(53 例)
(61 例)
21
48
49
49
イベント数 a)
中央値[95%信頼区間]
(日)
22.0[15.0, 28.0]
27.0[15.0, 28.0]
14.0[13.0, 14.0]
15.0[15.0, 27.0]
a)2 回連続で RT-PCR 検査結果が陰性の場合にイベント発現とされ、イベント発現日は 1 回目に RT-PCR 検査結果が陰性となった検
体の採取日とされた。なお、最後に採取された検体においてのみ RT-PCR 検査結果が陰性であった場合には、最後の採取時点がイ
ベント発現日とされた。
図1
RT-PCR 検査結果が陰性となった検体採取日までの時間の Kaplan-Meier 曲線(鼻咽頭ぬぐい検体)(MITT 集団)
安全性10)について、有害事象及び副作用11)は、本薬 200 mg 群で 47.8%(11/23 例)及び 17.4%(4/23
例)、本薬 400 mg 群で 32.3%(20/62 例)及び 21.0%(13/62 例)、本薬 800 mg 群で 20.0%(11/55 例)
及び 1.8%(1/55 例)、プラセボ群で 29.0%(18/62 例)及び 12.9%(8/62 例)に認められた。いずれかの
群で 2 例以上に認められた有害事象及び副作用の発現状況は表 3 のとおりであった。
表3
いずれかの群で 2 例以上に認められた有害事象及び副作用(安全性解析対象集団)
有害事象
副作用
本薬
本薬
本薬
本薬
本薬
本薬
事象名
プラセボ群
200 mg 群
400 mg 群
800 mg 群
200 mg 群
400 mg 群
800 mg 群
(62 例)
(23 例)
(62 例)
(55 例)
(23 例)
(62 例)
(55 例)
全体
11(47.8) 20(32.3) 11(20.0) 18(29.0)
4(17.4)
13(21.0)
1(1.8)
0
0
頭痛
1(4.3)
3(4.8)
2(3.6)
3(4.8)
2(3.2)
0
0
0
0
浮動性めまい
2(8.7)
1(1.6)
1(4.3)
0
0
0
0
0
0
錯感覚
2(3.2)
0
0
ALT 増加
2(3.2)
2(3.6)
2(3.2)
2(3.2)
1(1.8)
0
0
AST 増加
1(1.6)
2(3.6)
1(1.6)
1(1.6)
1(1.8)
0
0
0
0
0
血中クレアチニン増加
3(4.8)
3(4.8)
0
0
悪心
1(4.3)
2(3.2)
1(1.6)
1(4.3)
2(3.2)
0
0
0
0
0
腹痛
1(1.6)
2(3.2)
0
0
0
0
0
咳嗽
2(3.2)
1(1.8)
0
不眠症
2(8.7)
1(1.6)
1(1.8)
4(6.5)
2(8.7)
1(1.6)
例数(%)、MedDRA ver.23.0
10)
11)
プラセボ群
(62 例)
8(12.9)
0
0
0
2(3.2)
1(1.6)
0
1(1.6)
1(1.6)
0
3(4.8)
治験薬投与終了 14 日後までに認められた有害事象及び副作用
治験責任医師等により治験薬との因果関係ありと評価された有害事象
5
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
8
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。