よむ、つかう、まなぶ。
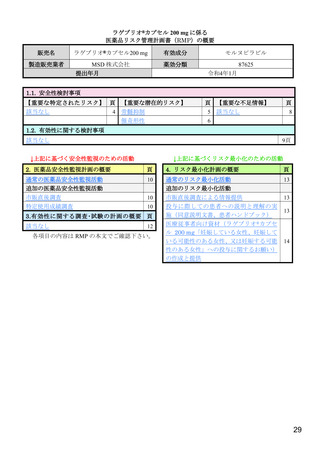
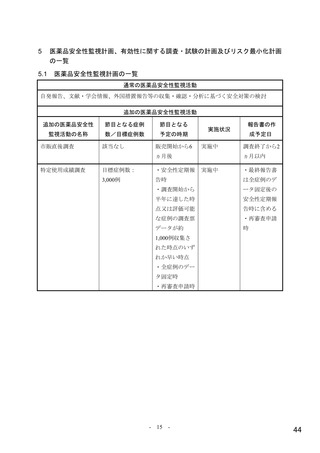
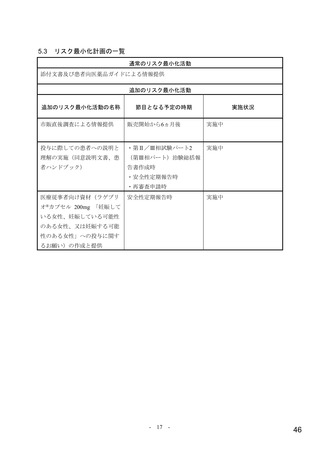
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
本試験の第Ⅱ相パートでは 2 回の中間解析が計画され14)、1 回目は用量の検討等を目的に本試験(第
Ⅱ相パート)及び国際共同第Ⅱ/Ⅲ相試験(MK-4482-001 試験、第Ⅱ相パート)15)合わせて 300 例の被験
者が治験薬投与を完了した時点、2 回目は第Ⅲ相パートの用量の決定等を目的に本試験(第Ⅱ相パート)
300 例の被験者の無作為化 29 日目までのフォローアップを完了した時点で実施される計画とされた。本
項においては 2 回目の中間解析の結果(第Ⅱ相パートの最終解析結果)を示す。
無作為化された 302 例(本薬 200 mg 群 75 例、本薬 400 mg 群 77 例、本薬 800 mg 群 76 例、プラセボ
群 74 例)のうち、治験薬が 1 回以上投与された 299 例(本薬 200 mg 群 74 例、本薬 400 mg 群 77 例、
本薬 800 mg 群 74 例、プラセボ群 74 例)が安全性解析対象及び MITT 集団とされ、MITT 集団が有効性
解析対象集団とされた。
試験中止例は 16 例(本薬 200 mg 群 5 例、本薬 400 mg 群 4 例、本薬 800 mg 群 4 例、プラセボ群 3 例)
であり、その内訳は、有害事象 4 例(本薬 800 mg 群 3 例、プラセボ群 1 例)、服薬コンプライアンス不
良 4 例(本薬 200 mg 群 2 例、本薬 400 mg 群 1 例、プラセボ群 1 例)、治験責任医師等の判断 2 例(本
薬 400 mg 群)、被験者の申し出 4 例(本薬 200 mg 群 1 例、本薬 400 mg 群 1 例、本薬 800 mg 群 1 例、
プラセボ群 1 例)、その他 2 例(本薬 200 mg 群 2 例)であった。
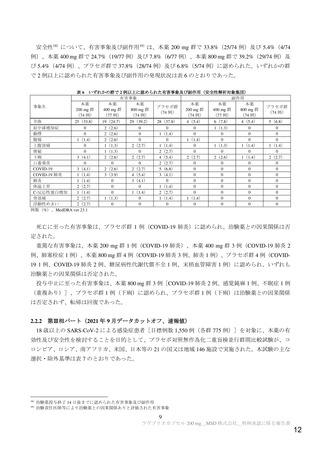
有効性について、主要評価項目である MITT 集団における無作為化 29 日目までの理由を問わない入
院16)又は死亡(以下、「イベント」)が認められた被験者の割合は表 5 のとおりであった。
表5
無作為化 29 日目までに理由を問わない入院又は死亡した被験者の割合 a)(MITT 集団)
本薬 200 mg 群
本薬 400 mg 群
本薬 800 mg 群
プラセボ群
イベント発現割合
1.4%(1/74 例) 3.9%(3/77 例) 4.1%(3/74 例) 5.4%(4/74 例)
全体
プラセボ群との差
-4.1
-1.5
-1.3
-
[95%信頼区間]b)
[-12.2, 2.5]
[-9.9, 6.2]
[-9.6, 6.4]
イベント発現割合
0%(0/18 例)
5.9%(1/17 例) 5.0%(1/20 例) 21.4%(3/14 例)
60 歳超
プラセボ群との差
-21.4
-15.5
-16.4
-
[95%信頼区間]c)
[-48.0, -1.2] [-43.5, 10.1]
[-44.0, 6.8]
イベント発現割合
1.8%(1/56 例) 5.0%(3/60 例) 5.6%(3/54 例) 7.4%(4/54 例)
SARS-CoV-2 による感染症の
プラセボ群との差
-5.6
-2.4
-1.9
重症化リスク因子を有する
-
[95%信頼区間]c)
[-16.1, 3.0]
[-13.3, 7.5]
[-12.9, 8.8]
イベント発現割合
2.0%(1/51 例) 3.8%(2/52 例) 2.1%(1/48 例) 8.0%(4/50 例)
SARS-CoV-2 による感染症の
プラセボ群との差
-6.0
-4.2
-5.9
症状の発現から 5 日以内
-
[95%信頼区間]c)
[-17.2, 3.3]
[-15.6, 6.2]
[-17.1, 3.9]
イベント発現割合
2.6%(1/38 例) 5.3%(2/38 例) 3.2%(1/31 例) 11.8%(4/34 例)
SARS-CoV-2 による感染症の
重症化リスク因子を有し、
プラセボ群との差
-9.1
-6.5
-8.5
-
症状の発現から 5 日以内
[95%信頼区間]c)
[-24.5, 3.5]
[-22.3, 7.5]
[-24.1, 6.1]
-:該当なし
a)無作為化 29 日目までの死亡は認められず、イベント発現例はすべて入院であった。無作為化 29 日目の生存状況が不明な場合はイベン
トとし、本試験を早期中止し無作為化 29 日目の生存状況が生存と判明しているが、入院状況が不明である場合は非イベントとされた。
b)SARS-CoV-2 による感染症の発症からの時間(5 日以下又は 5 日超)及び SARS-CoV-2 による感染症の重症化リスク因子の有無を層別
因子とした層別 Miettinen and Nurminen 法により算出
c)Miettinen and Nurminen 法により算出
ベースラインのウイルスゲノムの塩基配列の情報が得られた被験者(155 例)において認められた
SARS-CoV-2 の株17)は、主に 20A(23.9%)、20B(38.1%)、20C(12.9%)、20E(5.2%)及び 20G(15.5%)
であり、20D は 0.6%、20I(Alpha 株)は 0.6%、20H(Beta 株)は 3.2%であった。
中間解析は外部データモニタリング委員会(eDMC)及び本試験に直接的に関連していないスポンサー内のメンバーにより構成された
データモニタリング委員会(siDMC)により実施された。
15)
18 歳以上の SARS-CoV-2 による感染症の入院患者を対象として実施され、本薬 200 mg、400 mg、800 mg 又はプラセボを 1 日 2 回、5
日間経口投与することとされた。
16)
入院は、病院又は同様の急性期治療施設において 24 時間以上の急性期治療を行った場合と定義された。
17)
Nextstrain Clade(https://nextstrain.org/)
14)
8
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
11
Ⅱ相パート)及び国際共同第Ⅱ/Ⅲ相試験(MK-4482-001 試験、第Ⅱ相パート)15)合わせて 300 例の被験
者が治験薬投与を完了した時点、2 回目は第Ⅲ相パートの用量の決定等を目的に本試験(第Ⅱ相パート)
300 例の被験者の無作為化 29 日目までのフォローアップを完了した時点で実施される計画とされた。本
項においては 2 回目の中間解析の結果(第Ⅱ相パートの最終解析結果)を示す。
無作為化された 302 例(本薬 200 mg 群 75 例、本薬 400 mg 群 77 例、本薬 800 mg 群 76 例、プラセボ
群 74 例)のうち、治験薬が 1 回以上投与された 299 例(本薬 200 mg 群 74 例、本薬 400 mg 群 77 例、
本薬 800 mg 群 74 例、プラセボ群 74 例)が安全性解析対象及び MITT 集団とされ、MITT 集団が有効性
解析対象集団とされた。
試験中止例は 16 例(本薬 200 mg 群 5 例、本薬 400 mg 群 4 例、本薬 800 mg 群 4 例、プラセボ群 3 例)
であり、その内訳は、有害事象 4 例(本薬 800 mg 群 3 例、プラセボ群 1 例)、服薬コンプライアンス不
良 4 例(本薬 200 mg 群 2 例、本薬 400 mg 群 1 例、プラセボ群 1 例)、治験責任医師等の判断 2 例(本
薬 400 mg 群)、被験者の申し出 4 例(本薬 200 mg 群 1 例、本薬 400 mg 群 1 例、本薬 800 mg 群 1 例、
プラセボ群 1 例)、その他 2 例(本薬 200 mg 群 2 例)であった。
有効性について、主要評価項目である MITT 集団における無作為化 29 日目までの理由を問わない入
院16)又は死亡(以下、「イベント」)が認められた被験者の割合は表 5 のとおりであった。
表5
無作為化 29 日目までに理由を問わない入院又は死亡した被験者の割合 a)(MITT 集団)
本薬 200 mg 群
本薬 400 mg 群
本薬 800 mg 群
プラセボ群
イベント発現割合
1.4%(1/74 例) 3.9%(3/77 例) 4.1%(3/74 例) 5.4%(4/74 例)
全体
プラセボ群との差
-4.1
-1.5
-1.3
-
[95%信頼区間]b)
[-12.2, 2.5]
[-9.9, 6.2]
[-9.6, 6.4]
イベント発現割合
0%(0/18 例)
5.9%(1/17 例) 5.0%(1/20 例) 21.4%(3/14 例)
60 歳超
プラセボ群との差
-21.4
-15.5
-16.4
-
[95%信頼区間]c)
[-48.0, -1.2] [-43.5, 10.1]
[-44.0, 6.8]
イベント発現割合
1.8%(1/56 例) 5.0%(3/60 例) 5.6%(3/54 例) 7.4%(4/54 例)
SARS-CoV-2 による感染症の
プラセボ群との差
-5.6
-2.4
-1.9
重症化リスク因子を有する
-
[95%信頼区間]c)
[-16.1, 3.0]
[-13.3, 7.5]
[-12.9, 8.8]
イベント発現割合
2.0%(1/51 例) 3.8%(2/52 例) 2.1%(1/48 例) 8.0%(4/50 例)
SARS-CoV-2 による感染症の
プラセボ群との差
-6.0
-4.2
-5.9
症状の発現から 5 日以内
-
[95%信頼区間]c)
[-17.2, 3.3]
[-15.6, 6.2]
[-17.1, 3.9]
イベント発現割合
2.6%(1/38 例) 5.3%(2/38 例) 3.2%(1/31 例) 11.8%(4/34 例)
SARS-CoV-2 による感染症の
重症化リスク因子を有し、
プラセボ群との差
-9.1
-6.5
-8.5
-
症状の発現から 5 日以内
[95%信頼区間]c)
[-24.5, 3.5]
[-22.3, 7.5]
[-24.1, 6.1]
-:該当なし
a)無作為化 29 日目までの死亡は認められず、イベント発現例はすべて入院であった。無作為化 29 日目の生存状況が不明な場合はイベン
トとし、本試験を早期中止し無作為化 29 日目の生存状況が生存と判明しているが、入院状況が不明である場合は非イベントとされた。
b)SARS-CoV-2 による感染症の発症からの時間(5 日以下又は 5 日超)及び SARS-CoV-2 による感染症の重症化リスク因子の有無を層別
因子とした層別 Miettinen and Nurminen 法により算出
c)Miettinen and Nurminen 法により算出
ベースラインのウイルスゲノムの塩基配列の情報が得られた被験者(155 例)において認められた
SARS-CoV-2 の株17)は、主に 20A(23.9%)、20B(38.1%)、20C(12.9%)、20E(5.2%)及び 20G(15.5%)
であり、20D は 0.6%、20I(Alpha 株)は 0.6%、20H(Beta 株)は 3.2%であった。
中間解析は外部データモニタリング委員会(eDMC)及び本試験に直接的に関連していないスポンサー内のメンバーにより構成された
データモニタリング委員会(siDMC)により実施された。
15)
18 歳以上の SARS-CoV-2 による感染症の入院患者を対象として実施され、本薬 200 mg、400 mg、800 mg 又はプラセボを 1 日 2 回、5
日間経口投与することとされた。
16)
入院は、病院又は同様の急性期治療施設において 24 時間以上の急性期治療を行った場合と定義された。
17)
Nextstrain Clade(https://nextstrain.org/)
14)
8
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
11