よむ、つかう、まなぶ。
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (10 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
選択基準
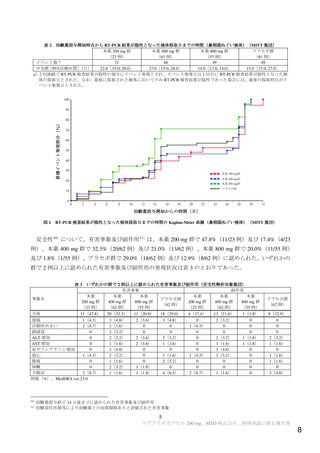
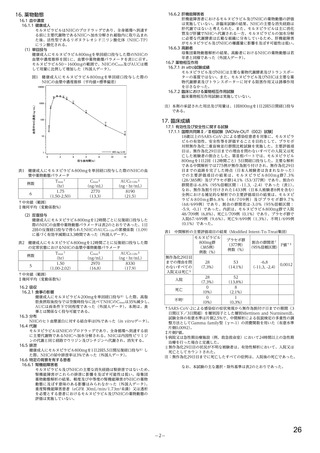
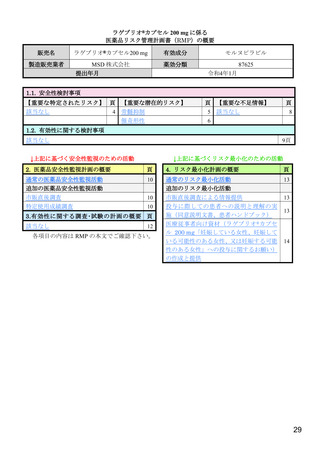
表 4 主な選択・除外基準
1. SARS-CoV-2 陽性(無作為化前 7 日以内に採取された検体を用いた PCR 検査等により確認)
2. SARS-CoV-2 による感染症の症状 a)発現が無作為化前 7 日以内であり、かつ無作為化時点において SARS-CoV-2
による感染症に関連する症状 b)が 1 つ以上認められる
3. 以下の定義における、中等症患者又は SARS-CoV-2 による感染症の重症化リスク因子を 1 つ以上有する軽症患者
SARS-CoV-2 による感染症の重症度の判断に用いられた定義は以下のとおり。
【軽症】①及び②を満たす
①次のすべてが認められる
呼吸数が 20 回/分未満、心拍数が 90 回/分未満、SpO2 が 93%超 c)
②次のいずれも認められない
安静時又は労作時の息切れ、呼吸不全 d)、ショック状態 e)、多臓器機能不全 f)
【中等症】①~③をすべて満たす
①次のうち、1 つ以上が認められる
労作時の息切れ、呼吸数が 20 回/分以上 30 回/分未満、心拍数が 90 回/分以上 125 回/分未満
②次のうち、いずれかが認められる
・SpO2 が 93%超 c)
・SpO2 値に関わらず、SARS-CoV-2 による感染症のために 2 L/min 以下の酸素投与を要する
③次のいずれも認められない
安静時の息切れ、呼吸不全 d)、ショック状態 e)、多臓器機能不全 f)
SARS-CoV-2 による感染症の重症化リスク因子は以下のとおり。
・ 60 歳超
・ 活動性のがん[免疫抑制や高い死亡率を伴わないがん(例:基底細胞がん)は除く]
・ 慢性腎臓病
・ 慢性閉塞性肺疾患
・ 固形臓器移植による免疫抑制状態
・ 肥満(BMI 30 kg/m2 以上)
・ 重篤な心疾患(心不全、冠動脈疾患、心筋症等)
・ 鎌状赤血球症
・ 糖尿病
4. 治験薬投与終了後少なくとも 90 日間避妊が可能な男性又は妊娠しておらず治験薬投与開始から 28 日間避妊が可
能な女性 g)
1. 入院中又は無作為化後 48 時間以内に SARS-CoV-2 による感染症のために入院が必要となることが想定される患者
2. 透析中又は eGFR が 30 mL/min/1.73 m2 未満
3. 直近の HIV RNA 量が 50 copies/mL 超又は CD4 が 200 cell/mm3 未満の HIV 感染者
4. 無作為化前 6 週以内に化学療法が必要であった患者
5. 好中球数が 500/mm3 未満の患者
6. 自家又は同種造血幹細胞移植を受けた患者
除外基準
7. HBV 又は HCV の既往を有し、肝硬変、末期肝疾患、肝細胞がん、又はスクリーニング時の AST 若しくは ALT が
基準値上限の 3 倍超の患者
8. 血小板数が 100,000/μL 未満又は無作為化前 5 日以内に血小板輸血を受けた患者
9. 慢性膵炎の既往歴を有する又は無作為化前 3 カ月以内に急性膵炎であった
10. ベースライン時の心拍数 50 回/分未満(安静時)
11. SARS-CoV-2 による感染症に対するワクチンの接種歴を有する患者
a)具体的な症状の規定なし。
b)咳、咽頭痛、鼻閉、鼻水、労作時の息切れ又は呼吸困難、筋肉又は体の痛み、疲労、発熱(38.0℃超)、悪寒、頭痛、悪心、嘔吐、下
痢、嗅覚消失、味覚消失
c)室内気又は SARS-CoV-2 による感染症以外の理由で酸素投与されており SARS-CoV-2 による感染症の症状発現以降に酸素量が増量さ
れていない状態における数値。
d)<呼吸不全>次の①~④を 1 つ以上要する場合:①気管内挿管及び人工呼吸器、
②鼻カニューレを用いた高流量酸素療法(流量 20 L/min
超、酸素割合 0.5 以上)、③非侵襲的陽圧換気、④ECMO
e)<ショック状態>収縮期血圧 90 mmHg 未満、拡張期血圧 60 mmHg 未満又は昇圧剤を要する場合
f)<多臓器不全>呼吸器、循環器、腎臓、血液、肝臓又は中枢神経系の 1 つ以上に不全又は障害が認められる急性期の患者と治験担当
医師が判断した場合
g)プロトコル改訂第 1 版(2020 年 12 月 17 日)で女性の避妊期間が、治験薬投与終了後 7 カ月間から治験薬投与開始から 28 日間に変
更された。
用法・用量は、本薬 200 mg、400 mg、800 mg 又はプラセボを 1 日 2 回13)、5 日間経口投与することと
された。
13)
12 時間(±2 時間)間隔で投与することとされた。
7
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
10
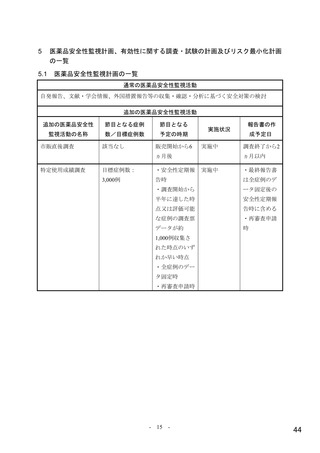
表 4 主な選択・除外基準
1. SARS-CoV-2 陽性(無作為化前 7 日以内に採取された検体を用いた PCR 検査等により確認)
2. SARS-CoV-2 による感染症の症状 a)発現が無作為化前 7 日以内であり、かつ無作為化時点において SARS-CoV-2
による感染症に関連する症状 b)が 1 つ以上認められる
3. 以下の定義における、中等症患者又は SARS-CoV-2 による感染症の重症化リスク因子を 1 つ以上有する軽症患者
SARS-CoV-2 による感染症の重症度の判断に用いられた定義は以下のとおり。
【軽症】①及び②を満たす
①次のすべてが認められる
呼吸数が 20 回/分未満、心拍数が 90 回/分未満、SpO2 が 93%超 c)
②次のいずれも認められない
安静時又は労作時の息切れ、呼吸不全 d)、ショック状態 e)、多臓器機能不全 f)
【中等症】①~③をすべて満たす
①次のうち、1 つ以上が認められる
労作時の息切れ、呼吸数が 20 回/分以上 30 回/分未満、心拍数が 90 回/分以上 125 回/分未満
②次のうち、いずれかが認められる
・SpO2 が 93%超 c)
・SpO2 値に関わらず、SARS-CoV-2 による感染症のために 2 L/min 以下の酸素投与を要する
③次のいずれも認められない
安静時の息切れ、呼吸不全 d)、ショック状態 e)、多臓器機能不全 f)
SARS-CoV-2 による感染症の重症化リスク因子は以下のとおり。
・ 60 歳超
・ 活動性のがん[免疫抑制や高い死亡率を伴わないがん(例:基底細胞がん)は除く]
・ 慢性腎臓病
・ 慢性閉塞性肺疾患
・ 固形臓器移植による免疫抑制状態
・ 肥満(BMI 30 kg/m2 以上)
・ 重篤な心疾患(心不全、冠動脈疾患、心筋症等)
・ 鎌状赤血球症
・ 糖尿病
4. 治験薬投与終了後少なくとも 90 日間避妊が可能な男性又は妊娠しておらず治験薬投与開始から 28 日間避妊が可
能な女性 g)
1. 入院中又は無作為化後 48 時間以内に SARS-CoV-2 による感染症のために入院が必要となることが想定される患者
2. 透析中又は eGFR が 30 mL/min/1.73 m2 未満
3. 直近の HIV RNA 量が 50 copies/mL 超又は CD4 が 200 cell/mm3 未満の HIV 感染者
4. 無作為化前 6 週以内に化学療法が必要であった患者
5. 好中球数が 500/mm3 未満の患者
6. 自家又は同種造血幹細胞移植を受けた患者
除外基準
7. HBV 又は HCV の既往を有し、肝硬変、末期肝疾患、肝細胞がん、又はスクリーニング時の AST 若しくは ALT が
基準値上限の 3 倍超の患者
8. 血小板数が 100,000/μL 未満又は無作為化前 5 日以内に血小板輸血を受けた患者
9. 慢性膵炎の既往歴を有する又は無作為化前 3 カ月以内に急性膵炎であった
10. ベースライン時の心拍数 50 回/分未満(安静時)
11. SARS-CoV-2 による感染症に対するワクチンの接種歴を有する患者
a)具体的な症状の規定なし。
b)咳、咽頭痛、鼻閉、鼻水、労作時の息切れ又は呼吸困難、筋肉又は体の痛み、疲労、発熱(38.0℃超)、悪寒、頭痛、悪心、嘔吐、下
痢、嗅覚消失、味覚消失
c)室内気又は SARS-CoV-2 による感染症以外の理由で酸素投与されており SARS-CoV-2 による感染症の症状発現以降に酸素量が増量さ
れていない状態における数値。
d)<呼吸不全>次の①~④を 1 つ以上要する場合:①気管内挿管及び人工呼吸器、
②鼻カニューレを用いた高流量酸素療法(流量 20 L/min
超、酸素割合 0.5 以上)、③非侵襲的陽圧換気、④ECMO
e)<ショック状態>収縮期血圧 90 mmHg 未満、拡張期血圧 60 mmHg 未満又は昇圧剤を要する場合
f)<多臓器不全>呼吸器、循環器、腎臓、血液、肝臓又は中枢神経系の 1 つ以上に不全又は障害が認められる急性期の患者と治験担当
医師が判断した場合
g)プロトコル改訂第 1 版(2020 年 12 月 17 日)で女性の避妊期間が、治験薬投与終了後 7 カ月間から治験薬投与開始から 28 日間に変
更された。
用法・用量は、本薬 200 mg、400 mg、800 mg 又はプラセボを 1 日 2 回13)、5 日間経口投与することと
された。
13)
12 時間(±2 時間)間隔で投与することとされた。
7
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
10