よむ、つかう、まなぶ。
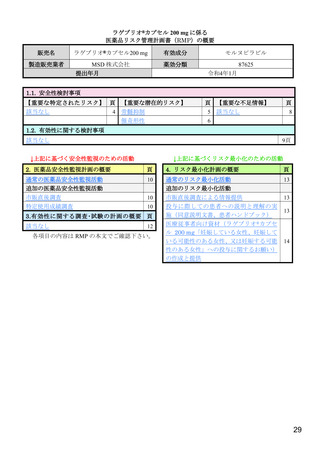
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (19 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
い[本薬群 1.0%(7/710 例)、プラセボ群 0.7%(5/701 例)]であった。死亡に至った有害事象は本薬群
2 例、プラセボ群 12 例、重篤な有害事象は本薬群 49 例、プラセボ群 67 例、投与中止に至った有害事象
は本薬群 10 例、プラセボ群 20 例に認められた。
なお、日本人は 8 例(本薬群 5 例、プラセボ群 3 例)が組み入れられ31)、このうち、治験薬が 1 回以
上投与された被験者は 7 例(本薬群 5 例、プラセボ群 2 例)であった。有効性について、主要評価項目
である無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者は 1 例(本薬群、入院)
であった。安全性について、有害事象は本薬群 2 例(低酸素症及び血管穿刺部位出血各 1 例)及びプラ
セボ群 1 例(血中ナトリウム減少)に認められ、このうち、低酸素症 1 例は重篤な有害事象であり、投
与中止に至った有害事象であった。いずれの有害事象も治験薬との因果関係は否定され、転帰は回復で
あった。死亡例は認められなかった。
3.
提出された資料のまとめ
3.1
有効性について
In vitro での検討において、本薬の主要代謝物である NHC は SARS-CoV-2 臨床分離株(USA-WA1/2020
株)に対して抗ウイルス活性が示されており(Vero E6 細胞、EC50:0.78~2.03 μmol/L)、SARS-CoV-2 の
変異株である B.1.1.7 系統(Alpha)、B.1.351 系統(Beta)、P.1 系統(Gamma)、B.1.617.2 系統(Delta)に
対する EC50 はそれぞれ 1.59、1.77、1.32、1.68 μmol/L(Vero E6 細胞)であり SARS-CoV-2 臨床分離株
(USA-WA1/2020 株)と同程度の抗ウイルス活性が認められた。また、SARS-CoV-2 臨床分離株(USAWA1/2020 株)を用いた in vivo での検討において、SARS-CoV-2 感染ヒト肺組織移植マウスのヒト肺組
織、SARS-CoV-2 感染フェレットの鼻甲介及び SARS-CoV-2 感染ハムスターの肺組織において本薬投与
により感染性ウイルス量の減少が認められていることから、非臨床の観点から本薬の SARS-CoV-2 に対
する抗ウイルス活性は期待できる。
また、SARS-CoV-2 による感染症患者を対象とした国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第
Ⅲ相パートの中間解析(2.2.2 参照)において、主要評価項目である無作為化 29 日目までに理由を問わ
ない入院又は死亡が認められた被験者の割合について、本薬群とプラセボ群との比較において統計的に
有意な差が認められており、本剤の SARS-CoV-2 による感染症に対する有効性は期待できると考える
(2.2.2 参照)
。なお、無作為化されたすべての被験者の無作為化 29 日目までのデータの解析結果32)にお
いて、中間解析結果と比べて本薬群とプラセボ群の群間差が小さくなった要因について、申請者により
中間解析前後での被験者背景33)や試験環境の相違等の影響について検討が行われたものの明らかな要因
は特定されなかった。中間解析の後、様々な要因が積み重なったことにより群間差が小さくなった可能
性はあるが、無作為化されたすべての被験者の無作為化 29 日目までのデータにおいても、本薬群でプラ
セボ群と比較して理由を問わない入院又は死亡が認められた被験者の割合が低い結果が認められており、
本剤の有効性を否定するものではないと考える。
以上を踏まえ、本剤の SARS-CoV-2 による感染症に対する有効性は期待できると考えるが、国際共同
中間解析には含まれなかった。
事前に計画された中間解析において早期有効中止となったことから、本試験の成功の可否を判定する上での主たる結果は中間解析の
主要評価項目の結果となるが、無作為化されたすべての被験者に関する解析結果は中間解析よりも多くの被験者の結果を含むことか
ら、当該結果も本薬の有効性を理解する上で参考になり得る。
33)
性別、年齢、人種、地域、民族、SARS-CoV-2 による感染症の症状発現から無作為化までの時間、SARS-CoV-2 による感染症の重症化
リスク因子、ベースラインにおける SARS-CoV-2 による感染症の重症度、ベースラインにおける SARS-CoV-2 RNA の検出の有無、ベ
ースラインにおける SARS-CoV-2 に対する抗体の有無、変異株の種類が検討された。
31)
32)
16
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
19
2 例、プラセボ群 12 例、重篤な有害事象は本薬群 49 例、プラセボ群 67 例、投与中止に至った有害事象
は本薬群 10 例、プラセボ群 20 例に認められた。
なお、日本人は 8 例(本薬群 5 例、プラセボ群 3 例)が組み入れられ31)、このうち、治験薬が 1 回以
上投与された被験者は 7 例(本薬群 5 例、プラセボ群 2 例)であった。有効性について、主要評価項目
である無作為化 29 日目までに理由を問わない入院又は死亡が認められた被験者は 1 例(本薬群、入院)
であった。安全性について、有害事象は本薬群 2 例(低酸素症及び血管穿刺部位出血各 1 例)及びプラ
セボ群 1 例(血中ナトリウム減少)に認められ、このうち、低酸素症 1 例は重篤な有害事象であり、投
与中止に至った有害事象であった。いずれの有害事象も治験薬との因果関係は否定され、転帰は回復で
あった。死亡例は認められなかった。
3.
提出された資料のまとめ
3.1
有効性について
In vitro での検討において、本薬の主要代謝物である NHC は SARS-CoV-2 臨床分離株(USA-WA1/2020
株)に対して抗ウイルス活性が示されており(Vero E6 細胞、EC50:0.78~2.03 μmol/L)、SARS-CoV-2 の
変異株である B.1.1.7 系統(Alpha)、B.1.351 系統(Beta)、P.1 系統(Gamma)、B.1.617.2 系統(Delta)に
対する EC50 はそれぞれ 1.59、1.77、1.32、1.68 μmol/L(Vero E6 細胞)であり SARS-CoV-2 臨床分離株
(USA-WA1/2020 株)と同程度の抗ウイルス活性が認められた。また、SARS-CoV-2 臨床分離株(USAWA1/2020 株)を用いた in vivo での検討において、SARS-CoV-2 感染ヒト肺組織移植マウスのヒト肺組
織、SARS-CoV-2 感染フェレットの鼻甲介及び SARS-CoV-2 感染ハムスターの肺組織において本薬投与
により感染性ウイルス量の減少が認められていることから、非臨床の観点から本薬の SARS-CoV-2 に対
する抗ウイルス活性は期待できる。
また、SARS-CoV-2 による感染症患者を対象とした国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第
Ⅲ相パートの中間解析(2.2.2 参照)において、主要評価項目である無作為化 29 日目までに理由を問わ
ない入院又は死亡が認められた被験者の割合について、本薬群とプラセボ群との比較において統計的に
有意な差が認められており、本剤の SARS-CoV-2 による感染症に対する有効性は期待できると考える
(2.2.2 参照)
。なお、無作為化されたすべての被験者の無作為化 29 日目までのデータの解析結果32)にお
いて、中間解析結果と比べて本薬群とプラセボ群の群間差が小さくなった要因について、申請者により
中間解析前後での被験者背景33)や試験環境の相違等の影響について検討が行われたものの明らかな要因
は特定されなかった。中間解析の後、様々な要因が積み重なったことにより群間差が小さくなった可能
性はあるが、無作為化されたすべての被験者の無作為化 29 日目までのデータにおいても、本薬群でプラ
セボ群と比較して理由を問わない入院又は死亡が認められた被験者の割合が低い結果が認められており、
本剤の有効性を否定するものではないと考える。
以上を踏まえ、本剤の SARS-CoV-2 による感染症に対する有効性は期待できると考えるが、国際共同
中間解析には含まれなかった。
事前に計画された中間解析において早期有効中止となったことから、本試験の成功の可否を判定する上での主たる結果は中間解析の
主要評価項目の結果となるが、無作為化されたすべての被験者に関する解析結果は中間解析よりも多くの被験者の結果を含むことか
ら、当該結果も本薬の有効性を理解する上で参考になり得る。
33)
性別、年齢、人種、地域、民族、SARS-CoV-2 による感染症の症状発現から無作為化までの時間、SARS-CoV-2 による感染症の重症化
リスク因子、ベースラインにおける SARS-CoV-2 による感染症の重症度、ベースラインにおける SARS-CoV-2 RNA の検出の有無、ベ
ースラインにおける SARS-CoV-2 に対する抗体の有無、変異株の種類が検討された。
31)
32)
16
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
19