よむ、つかう、まなぶ。
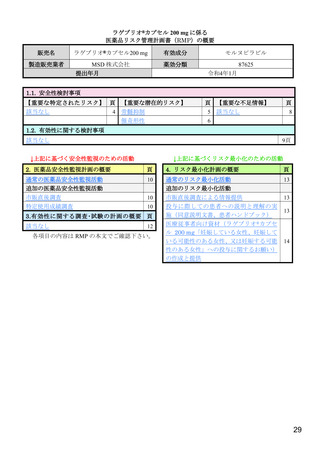
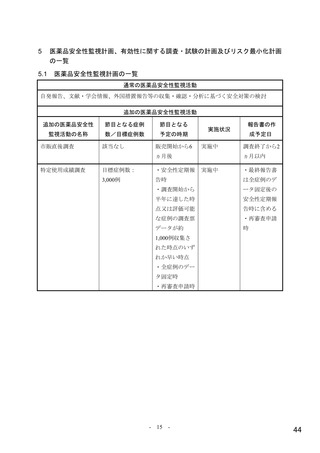
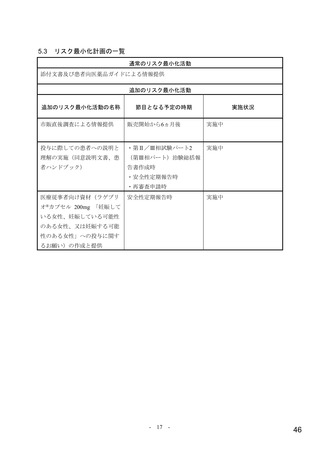
【資料4】モルヌピラビル(ラゲブリオカプセル200mg )の安全性について(医薬・生活衛生局の説明資料) (21 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24538.html |
| 出典情報 | 医薬品等行政評価・監視委員会(第7回 3/18)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
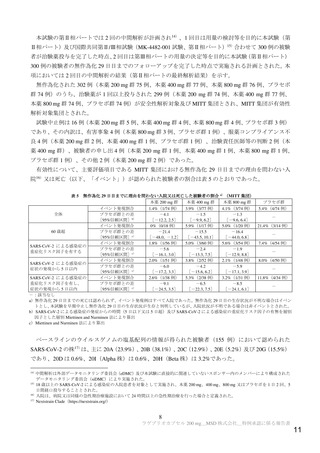
本剤の安全性について、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートは速報値のみが
得られていること及び日本人における本剤の投与経験は極めて限られていることから、明確に結論付け
ることは困難であるものの、臨床試験における有害事象の発現状況(2.1、2.2 及び 3.2 参照)
、英国にお
いて Conditional Marketing Authorization が得られていること、 米国 FDA において Emergency Use
Authorization が申請され Advisory Committee において許可勧告されていること等を踏まえると、添付文
書において、英国の SUMMARY OF PRODUCT CHARACTERISTICS と同様の注意喚起を行うことに加え
て、以下の点について注意喚起を行うことで本剤の安全性リスクは管理可能と考える。また、本剤の日
本人における安全性について、製造販売後も引き続き情報収集し、新たな知見が得られた場合には速や
かに医療現場に情報提供する必要がある。
3.2.1
妊婦又は妊娠している可能性のある女性等への投与について
妊婦又は妊娠している可能性のある女性への投与について、以下の点を踏まえ禁忌とすることが適切
と考える。
生殖発生毒性試験として、ラットを用いた受胎能及び着床までの初期胚発生に関する試験、並びに
ラット及びウサギを用いた胚・胎児発生に関する試験が実施され、主な毒性所見として、ラットを
用いた胚・胎児発生に関する試験の胎児において、外表、内臓及び骨格奇形、胎児体重低値及び仙
椎平均椎骨数低値が認められた。なお、非臨床試験において、本薬及び NHC に遺伝毒性リスクは認
められていない。
催奇形性に対する無毒性量(本薬 500 mg/kg)を投与したときの血漿中 NHC 曝露量(AUC0-24 h)は、
217 µmol・h/L、胚・胎児に対する無毒性量(本薬 250 mg/kg)を投与したときの血漿中 NHC 曝露量
(AUC0- 24 h)は 58.3 µmol・h/L であり、当該曝露量は、ヒトに本薬を投与したときの血漿中 NHC 曝
露量(AUC0- 24 h:75.6 μmol・h/L36))と比較してそれぞれ約 2.9 倍及び約 0.8 倍であった。
臨床試験において妊婦は除外されたため、妊婦への投与に関する安全性情報は得られていないが、
非臨床試験成績を踏まえると本薬はヒトに対して、潜在的な催奇形性リスクを有する可能性が考え
られること。
本邦において、妊婦に対して投与可能な SARS-CoV-2 による感染症に対する治療薬が承認されてい
ること。
なお、授乳婦への投与については、本薬を授乳婦へ投与した場合の乳汁移行性は不明であるものの、
ラットを用いた出生前及び出生後の発生並びに母体の機能試験において、新生児発育に対して、本薬曝
露の影響が認められないことから、授乳に対する安全性上の懸念は低いと考える。
3.3
効能・効果、用法・用量及び臨床的位置付けについて
国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートの速報値を踏まえると、本剤の効能・効
果は SARS-CoV-2 による感染症とし、用法・用量は、通常、18 歳以上の患者には、モルヌピラビルとし
て 1 回 800 mg を 1 日 2 回、5 日間経口投与とすることが適切と考える。
また、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートにおいては、概ね軽症~中等症Ⅰ 37)
母集団薬物動態モデルにより推定した、SARS-CoV-2 による感染症患者(MK-4482-001 試験及び MK-4482-002 試験の第Ⅱ相パート)
に本薬 800 mg を 12 時間間隔で投与した場合の定常状態における血漿中 NHC 曝露量(AUC0-24 h)の推定値
37)
厚生労働省 新型コロナウイルス感染症(COVID-19)診療の手引き・第 6.0 版
36)
18
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
21
得られていること及び日本人における本剤の投与経験は極めて限られていることから、明確に結論付け
ることは困難であるものの、臨床試験における有害事象の発現状況(2.1、2.2 及び 3.2 参照)
、英国にお
いて Conditional Marketing Authorization が得られていること、 米国 FDA において Emergency Use
Authorization が申請され Advisory Committee において許可勧告されていること等を踏まえると、添付文
書において、英国の SUMMARY OF PRODUCT CHARACTERISTICS と同様の注意喚起を行うことに加え
て、以下の点について注意喚起を行うことで本剤の安全性リスクは管理可能と考える。また、本剤の日
本人における安全性について、製造販売後も引き続き情報収集し、新たな知見が得られた場合には速や
かに医療現場に情報提供する必要がある。
3.2.1
妊婦又は妊娠している可能性のある女性等への投与について
妊婦又は妊娠している可能性のある女性への投与について、以下の点を踏まえ禁忌とすることが適切
と考える。
生殖発生毒性試験として、ラットを用いた受胎能及び着床までの初期胚発生に関する試験、並びに
ラット及びウサギを用いた胚・胎児発生に関する試験が実施され、主な毒性所見として、ラットを
用いた胚・胎児発生に関する試験の胎児において、外表、内臓及び骨格奇形、胎児体重低値及び仙
椎平均椎骨数低値が認められた。なお、非臨床試験において、本薬及び NHC に遺伝毒性リスクは認
められていない。
催奇形性に対する無毒性量(本薬 500 mg/kg)を投与したときの血漿中 NHC 曝露量(AUC0-24 h)は、
217 µmol・h/L、胚・胎児に対する無毒性量(本薬 250 mg/kg)を投与したときの血漿中 NHC 曝露量
(AUC0- 24 h)は 58.3 µmol・h/L であり、当該曝露量は、ヒトに本薬を投与したときの血漿中 NHC 曝
露量(AUC0- 24 h:75.6 μmol・h/L36))と比較してそれぞれ約 2.9 倍及び約 0.8 倍であった。
臨床試験において妊婦は除外されたため、妊婦への投与に関する安全性情報は得られていないが、
非臨床試験成績を踏まえると本薬はヒトに対して、潜在的な催奇形性リスクを有する可能性が考え
られること。
本邦において、妊婦に対して投与可能な SARS-CoV-2 による感染症に対する治療薬が承認されてい
ること。
なお、授乳婦への投与については、本薬を授乳婦へ投与した場合の乳汁移行性は不明であるものの、
ラットを用いた出生前及び出生後の発生並びに母体の機能試験において、新生児発育に対して、本薬曝
露の影響が認められないことから、授乳に対する安全性上の懸念は低いと考える。
3.3
効能・効果、用法・用量及び臨床的位置付けについて
国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートの速報値を踏まえると、本剤の効能・効
果は SARS-CoV-2 による感染症とし、用法・用量は、通常、18 歳以上の患者には、モルヌピラビルとし
て 1 回 800 mg を 1 日 2 回、5 日間経口投与とすることが適切と考える。
また、国際共同第Ⅱ/Ⅲ相試験(MK-4482-002 試験)の第Ⅲ相パートにおいては、概ね軽症~中等症Ⅰ 37)
母集団薬物動態モデルにより推定した、SARS-CoV-2 による感染症患者(MK-4482-001 試験及び MK-4482-002 試験の第Ⅱ相パート)
に本薬 800 mg を 12 時間間隔で投与した場合の定常状態における血漿中 NHC 曝露量(AUC0-24 h)の推定値
37)
厚生労働省 新型コロナウイルス感染症(COVID-19)診療の手引き・第 6.0 版
36)
18
ラゲブリオカプセル 200 mg_MSD 株式会社_特例承認に係る報告書
21