よむ、つかう、まなぶ。
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (40 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
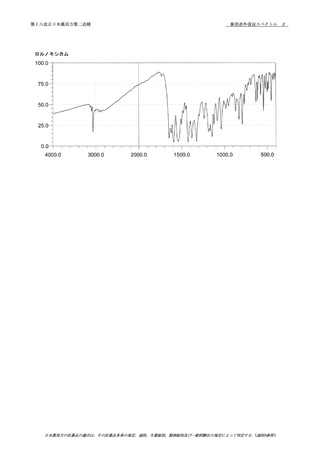
12 デキストラン70
第十八改正日本薬局方第二追補
1
n回目の溶出液採取時における炭酸リチウム(Li2CO3)の表示
2
量に対する溶出率(%) (n=1,2)
3
{
=
4
n-1
(AT(n) - 検量線の縦軸切片)+
軸切片) ×
1
45
}
×
Σ (A - 検量線の縦
i =1
42
43
エンドトキシン〈4.01〉 4.2 EU/g未満.
同条抗原性試験及び発熱性物質の項を削る.
T(i)
1
1
V´
×
V × C × 90
検量線の傾き
5
C:1錠中の炭酸リチウム(Li2CO3)の表示量(mg)
6
使用ガス:
44
医薬品各条の部
テセロイキン(遺伝子組換え)の条確認試験
45
の項(2)の目,分子量の項,純度試験の項(1),(2)及
46
び(4)の目並びに酢酸の項を次のように改める.
47
テセロイキン(遺伝子組換え)
7
可燃性ガス
アセチレン
48
確認試験
8
支燃性ガス
空気
49
(2)
9
ランプ:リチウム中空陰極ランプ
50
ぞれ1 mL中にタンパク質約0.6 mgを含む液となるように水
10
波長:670.8 nm
51
を加える.これらの液320 μLに,pH 9.0の1 mol/Lトリス緩
52
衝液及び薄めたテセロイキン用リシルエンドペプチダーゼ(1
11
定量法
本品20個以上をとり,その質量を精密に量り,粉末
本品及び確認試験用テセロイキンの適量をとり,それ
12
とする.炭酸リチウム(Li2CO3)約1 gに対応する量を精密に
53
→10000)を40 μLずつ加え,37°Cで2時間反応した後,1
13
量り,水100 mL及び0.5 mol/L硫酸50 mLを正確に加え,静
54
mol/L塩酸試液40 μLを加えて反応を停止し,試料溶液及び
14
か に 煮 沸 し て二 酸 化 炭 素 を除 き , 冷 後 ,過 量 の 硫 酸 を 1
55
標準溶液とする.試料溶液及び標準溶液40 μLにつき,次の
15
mol/L水酸化ナトリウム液で滴定〈2.50〉 する(指示薬:メチ
56
条件で液体クロマトグラフィー 〈2.01〉 により試験を行い,
16
ルレッド試液3滴).ただし,滴定の終点は液の赤色が黄色に
57
両者のクロマトグラムを比較するとき,同一の保持時間のと
17
変わるときとする.同様の方法で空試験を行う.
58
ころに同様のピークを認める.
18
19
20
0.5 mol/L 硫酸 1 mL=36.95 mg Li2CO3
貯法
容器 密閉容器.
医薬品各条の部
デキストラン 70 の条基原の項の次に次を
21
加える.
22
デキストラン70
59
検出器:紫外吸光光度計(測定波長:214 nm)
61
カラム:内径4.6 mm,長さ15 cmのステンレス管に3
62
μmの液体クロマトグラフィー用オクタデシルシリル
63
化シリカゲルを充塡する.
64
カラム温度:30℃付近の一定温度
65
移動相A:トリフルオロ酢酸試液
66
移動相B:液体クロマトグラフィー用アセトニトリル/
67
68
23
製造要件
本品は,抗原性を有する可能性のある不純物を除去
24
又は最小とする製造方法で製造する.製造方法は,以下の抗
25
原性試験を実施した場合に適合することが,検証された方法
26
とする.
27
抗原性試験 本品6.0 gを生理食塩液に溶かして100 mLと
28
し,滅菌し,試料溶液とする.体重250 ~ 300 gの栄養
試験条件
60
水/トリフルオロ酢酸混液(950:50:1)
移動相の送液:移動相A及び移動相Bの混合比を次のよ
69
うに変えて濃度勾配制御する.
注入後の時間
(分)
0~ 3
3 ~ 15
15 ~ 25
25 ~ 35
移動相A
(vol%)
98
98 → 55
55 → 30
30
移動相B
(vol%)
2
2 → 45
45 → 70
70
29
状態の良い健康なモルモット4匹を用い,第1日目,第3
70
30
日目及び第5日目に試料溶液1.0 mLずつを腹腔内に注射
71
31
する.別に対照として,同数のモルモットに馬血清0.10
72
32
mLを腹腔内に注射する.第15日目に2匹,第22日目に
73
操作するとき,保持時間3分付近に溶媒のピークを認
33
残りの2匹に,試料溶液を注射したモルモットに対して
74
め,保持時間4分から20分付近までにテセロイキンを
34
は試料溶液0.20 mLを静脈内に注射し,同様に馬血清を
75
構成するペプチドの主要な9本のピークを認める.ま
注射したモルモットに対しては馬血清0.20 mLを静脈内
76
た,6本目のピークと7本目のピークの分離度は1.5以
77
上である.
35
36
に注射する.注射後30分間及び24時間の呼吸困難,虚
37
脱又は致死を観察するとき,試料溶液によって感作した
38
モルモットは前記の症状を示さない.
39
ただし,馬血清によって感作したモルモットの4匹の
40
全部が呼吸困難又は虚脱を示し,3匹以上が死亡する.
41
同条強熱残分の項の次に次を加える.
78
流量:毎分1.0 mL
システム適合性
システムの性能:標準溶液40 μLにつき,上記の条件で
分子量
本品10 μLに,水45 μL,還元試液20 μL及びテセロ
79
イキン試料用緩衝液25 μLを加え,65℃で10分間加熱し,試
80
料溶液とする.試料溶液10 μL及びテセロイキン用分子量マ
81
ーカー10 μLにつき,テセロイキンSDSポリアクリルアミド
82
ゲル電気泳動用緩衝液及びテセロイキン用ポリアクリルアミ
83
ドゲルを用いて電気泳動を行う.泳動後,クーマシーブリリ
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )
第十八改正日本薬局方第二追補
1
n回目の溶出液採取時における炭酸リチウム(Li2CO3)の表示
2
量に対する溶出率(%) (n=1,2)
3
{
=
4
n-1
(AT(n) - 検量線の縦軸切片)+
軸切片) ×
1
45
}
×
Σ (A - 検量線の縦
i =1
42
43
エンドトキシン〈4.01〉 4.2 EU/g未満.
同条抗原性試験及び発熱性物質の項を削る.
T(i)
1
1
V´
×
V × C × 90
検量線の傾き
5
C:1錠中の炭酸リチウム(Li2CO3)の表示量(mg)
6
使用ガス:
44
医薬品各条の部
テセロイキン(遺伝子組換え)の条確認試験
45
の項(2)の目,分子量の項,純度試験の項(1),(2)及
46
び(4)の目並びに酢酸の項を次のように改める.
47
テセロイキン(遺伝子組換え)
7
可燃性ガス
アセチレン
48
確認試験
8
支燃性ガス
空気
49
(2)
9
ランプ:リチウム中空陰極ランプ
50
ぞれ1 mL中にタンパク質約0.6 mgを含む液となるように水
10
波長:670.8 nm
51
を加える.これらの液320 μLに,pH 9.0の1 mol/Lトリス緩
52
衝液及び薄めたテセロイキン用リシルエンドペプチダーゼ(1
11
定量法
本品20個以上をとり,その質量を精密に量り,粉末
本品及び確認試験用テセロイキンの適量をとり,それ
12
とする.炭酸リチウム(Li2CO3)約1 gに対応する量を精密に
53
→10000)を40 μLずつ加え,37°Cで2時間反応した後,1
13
量り,水100 mL及び0.5 mol/L硫酸50 mLを正確に加え,静
54
mol/L塩酸試液40 μLを加えて反応を停止し,試料溶液及び
14
か に 煮 沸 し て二 酸 化 炭 素 を除 き , 冷 後 ,過 量 の 硫 酸 を 1
55
標準溶液とする.試料溶液及び標準溶液40 μLにつき,次の
15
mol/L水酸化ナトリウム液で滴定〈2.50〉 する(指示薬:メチ
56
条件で液体クロマトグラフィー 〈2.01〉 により試験を行い,
16
ルレッド試液3滴).ただし,滴定の終点は液の赤色が黄色に
57
両者のクロマトグラムを比較するとき,同一の保持時間のと
17
変わるときとする.同様の方法で空試験を行う.
58
ころに同様のピークを認める.
18
19
20
0.5 mol/L 硫酸 1 mL=36.95 mg Li2CO3
貯法
容器 密閉容器.
医薬品各条の部
デキストラン 70 の条基原の項の次に次を
21
加える.
22
デキストラン70
59
検出器:紫外吸光光度計(測定波長:214 nm)
61
カラム:内径4.6 mm,長さ15 cmのステンレス管に3
62
μmの液体クロマトグラフィー用オクタデシルシリル
63
化シリカゲルを充塡する.
64
カラム温度:30℃付近の一定温度
65
移動相A:トリフルオロ酢酸試液
66
移動相B:液体クロマトグラフィー用アセトニトリル/
67
68
23
製造要件
本品は,抗原性を有する可能性のある不純物を除去
24
又は最小とする製造方法で製造する.製造方法は,以下の抗
25
原性試験を実施した場合に適合することが,検証された方法
26
とする.
27
抗原性試験 本品6.0 gを生理食塩液に溶かして100 mLと
28
し,滅菌し,試料溶液とする.体重250 ~ 300 gの栄養
試験条件
60
水/トリフルオロ酢酸混液(950:50:1)
移動相の送液:移動相A及び移動相Bの混合比を次のよ
69
うに変えて濃度勾配制御する.
注入後の時間
(分)
0~ 3
3 ~ 15
15 ~ 25
25 ~ 35
移動相A
(vol%)
98
98 → 55
55 → 30
30
移動相B
(vol%)
2
2 → 45
45 → 70
70
29
状態の良い健康なモルモット4匹を用い,第1日目,第3
70
30
日目及び第5日目に試料溶液1.0 mLずつを腹腔内に注射
71
31
する.別に対照として,同数のモルモットに馬血清0.10
72
32
mLを腹腔内に注射する.第15日目に2匹,第22日目に
73
操作するとき,保持時間3分付近に溶媒のピークを認
33
残りの2匹に,試料溶液を注射したモルモットに対して
74
め,保持時間4分から20分付近までにテセロイキンを
34
は試料溶液0.20 mLを静脈内に注射し,同様に馬血清を
75
構成するペプチドの主要な9本のピークを認める.ま
注射したモルモットに対しては馬血清0.20 mLを静脈内
76
た,6本目のピークと7本目のピークの分離度は1.5以
77
上である.
35
36
に注射する.注射後30分間及び24時間の呼吸困難,虚
37
脱又は致死を観察するとき,試料溶液によって感作した
38
モルモットは前記の症状を示さない.
39
ただし,馬血清によって感作したモルモットの4匹の
40
全部が呼吸困難又は虚脱を示し,3匹以上が死亡する.
41
同条強熱残分の項の次に次を加える.
78
流量:毎分1.0 mL
システム適合性
システムの性能:標準溶液40 μLにつき,上記の条件で
分子量
本品10 μLに,水45 μL,還元試液20 μL及びテセロ
79
イキン試料用緩衝液25 μLを加え,65℃で10分間加熱し,試
80
料溶液とする.試料溶液10 μL及びテセロイキン用分子量マ
81
ーカー10 μLにつき,テセロイキンSDSポリアクリルアミド
82
ゲル電気泳動用緩衝液及びテセロイキン用ポリアクリルアミ
83
ドゲルを用いて電気泳動を行う.泳動後,クーマシーブリリ
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )