よむ、つかう、まなぶ。
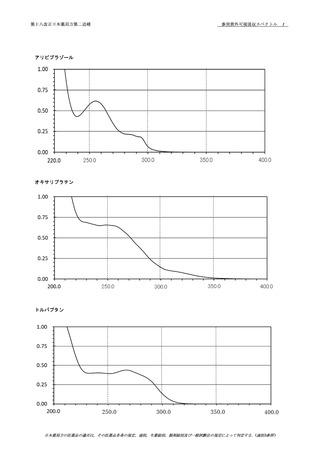
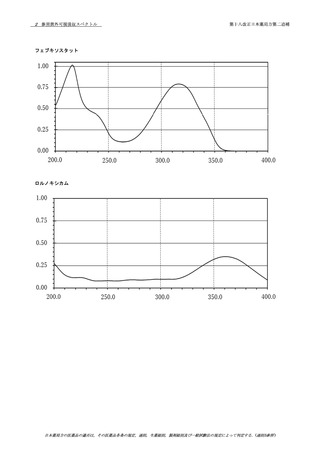
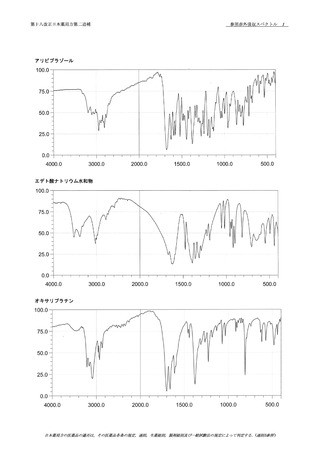
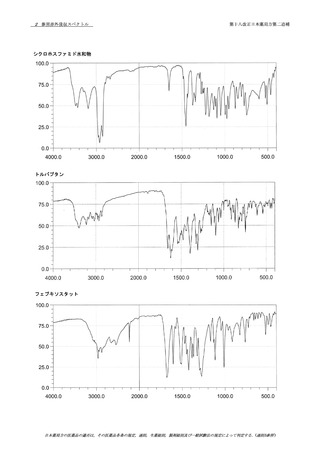
資料No.1-1~1-5_第十八改正日本薬局方第二追補(案) (39 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000174942_00008.html |
| 出典情報 | 薬事・食品衛生審議会 日本薬局方部会(令和5年度第1回 1/22)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
炭酸リチウム錠 11
第十八改正日本薬局方第二追補
1
2
医薬品各条の部
ステアリン酸ポリオキシル 40 の条純度試
36
験の項ヒ素の目を削る.
3
医薬品各条の部
35
ステアリン酸マグネシウムの条純度試験の
4
項(2)の目を次のように改める.
5
ステアリン酸マグネシウム
6
純度試験
7
(2)
8
硝酸1 mL及び水を加えて50 mLとする.これを検液とし,
9
試験を行う.比較液には0.02 mol/L塩酸1.4 mLを加える
10
(0.1%以下).
37
38
39
確認試験で得た試料溶液10.0 mLに
塩化物 〈1.03〉
医薬品各条の部
12
医薬品各条の部
13
医薬品各条の部
14
15
医薬品各条の部
セファドロキシルカプセルの条を削る.
シロップ用セファドロキシルの条を削る.
ソルビタンセスキオレイン酸エステルの条
純度試験の項ヒ素の目を削る.
16
医薬品各条の部
タルクの条冒頭の国際調和に関する記載及
17
び純度試験の項(2)の目を次のように改める.
18
タルク
19
本医薬品各条は,三薬局方での調和合意に基づき規定した医薬品
20
各条である.
の目を削る.
医薬品各条の部
炭酸ナトリウム水和物の条純度試験の項ヒ
素の目を削る.
医薬品各条の部
炭酸リチウムの条の次に次の一条を加える.
炭酸リチウム錠
41
Lithium Carbonate Tablets
42
セファドロキシルの条を削る.
乾燥炭酸ナトリウムの条純度試験の項ヒ素
40
43
11
医薬品各条の部
44
.
本品は定量するとき,表示量の95.0 ~ 105.0%に対応す
る炭酸リチウム(Li2CO3:73.89)を含む.
製法 本品は「炭酸リチウム」をとり,錠剤の製法により製す
45
る.
46
確認試験
47
(1)本品を粉末とし,炎色反応試験(1) 〈1.04〉 を行うとき,
48
持続する赤色を呈する.
49
(2)本品を粉末とし,「炭酸リチウム」0.2 gに対応する量
50
をとり,希塩酸3 mLを加えてよく振り混ぜ,水を加えて20
51
mLとし,ろ過する.ろ液5 mLに水酸化ナトリウム試液2
52
mL及びリン酸水素二ナトリウム試液2 mLを加えて加温した
53
後,冷却するとき,白色の沈殿を生じる.この沈殿は希塩酸
54
2 mLを追加するとき,溶ける.
55
(3)本品を粉末とし,「炭酸リチウム」0.5 gに対応する量
56
をとり,水50 mLを加えてよく振り混ぜた後,ろ過した液は
57
炭酸塩の定性反応〈1.09〉を呈する.
58
製剤均一性〈6.02〉 質量偏差試験を行うとき,適合する.
59
溶出性〈6.10〉 試験液に水900 mLを用い,パドル法により,
60
毎分100回転で試験を行うとき,100 mg錠の15分間及び180
61
分間の溶出率はそれぞれ45%以下及び80%以上であり,200
62
mg錠の30分間及び180分間の溶出率はそれぞれ50%以下及
63
び80%以上である.
64
本品1個をとり,試験を開始し,規定された時間にそれぞ
65
れ溶出液20 mLを正確にとり,直ちに37±0.5℃に加温した
21
なお,三薬局方で調和されていない部分のうち,調和合意におい
22
66
水20 mLを正確に注意して補う.溶出液は孔径0.45 μm以下
て,調和の対象とされた項中非調和となっている項の該当箇所は
23
67
のメンブランフィルターでろ過する.初めのろ液10 mL以上
「
24
68
を除き,次のろ液V mLを正確に量り,希塩酸5 mLを正確に
することとした項は「
◆
◆
」で,調和の対象とされた項以外に日本薬局方が独自に規定
◇
」で囲むことにより示す.
69
加え,1 mL中に炭酸リチウム(Li2CO3)約4.4 μgを含む液と
70
なるように水を加えて正確にV ´ mLとし,試料溶液とする.
71
別に定量用炭酸リチウムを105℃で3時間乾燥し,その約22
72
mgを精密に量り,水に溶かし,正確に100 mLとする.この
本品約1 gを精密に量り,希塩酸20 mLを加
73
液0.5 mL,2 mL,3 mL,4 mL 及び 5 mLをそれぞれ正確
29
え,50℃で15分間かき混ぜながら加温し,冷後,水を加え
74
に量り,水を加えてそれぞれ正確に20 mLとする.これらの
30
て正確に50 mLとし,ろ過する.必要ならば澄明になるまで
75
液5 mLを正確に量り,希塩酸5 mLを正確に加え,更に水を
遠心分離し,この液25 mLをとり,希硫酸1 mLを加えて蒸
76
加えてそれぞれ正確に50 mLとし,標準溶液(1),標準溶液
32
発乾固し,800±25℃で恒量になるまで強熱するとき,その
77
(2),標準溶液(3),標準溶液(4)及び標準溶液(5)とする.試料
33
量は2.0%以下である.◇
78
溶液及び標準溶液につき,次の条件で原子吸光光度法
79
〈2.23〉 により試験を行い,吸光度 AT(n) , AS1 , AS2 , AS3 ,
同条純度試験の項(8)の目を削る.
80
AS4及びAS5を測定し,標準溶液の濃度と吸光度の関係から得
81
た検量線を用いて溶出率(%)を求める.
25
三薬局方の調和合意に関する情報については,独立行政法人医薬
26
品医療機器総合機構のウェブサイトに掲載している.
27
純度試験
28
◇
31
34
◇
(2)
酸可溶物
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )
第十八改正日本薬局方第二追補
1
2
医薬品各条の部
ステアリン酸ポリオキシル 40 の条純度試
36
験の項ヒ素の目を削る.
3
医薬品各条の部
35
ステアリン酸マグネシウムの条純度試験の
4
項(2)の目を次のように改める.
5
ステアリン酸マグネシウム
6
純度試験
7
(2)
8
硝酸1 mL及び水を加えて50 mLとする.これを検液とし,
9
試験を行う.比較液には0.02 mol/L塩酸1.4 mLを加える
10
(0.1%以下).
37
38
39
確認試験で得た試料溶液10.0 mLに
塩化物 〈1.03〉
医薬品各条の部
12
医薬品各条の部
13
医薬品各条の部
14
15
医薬品各条の部
セファドロキシルカプセルの条を削る.
シロップ用セファドロキシルの条を削る.
ソルビタンセスキオレイン酸エステルの条
純度試験の項ヒ素の目を削る.
16
医薬品各条の部
タルクの条冒頭の国際調和に関する記載及
17
び純度試験の項(2)の目を次のように改める.
18
タルク
19
本医薬品各条は,三薬局方での調和合意に基づき規定した医薬品
20
各条である.
の目を削る.
医薬品各条の部
炭酸ナトリウム水和物の条純度試験の項ヒ
素の目を削る.
医薬品各条の部
炭酸リチウムの条の次に次の一条を加える.
炭酸リチウム錠
41
Lithium Carbonate Tablets
42
セファドロキシルの条を削る.
乾燥炭酸ナトリウムの条純度試験の項ヒ素
40
43
11
医薬品各条の部
44
.
本品は定量するとき,表示量の95.0 ~ 105.0%に対応す
る炭酸リチウム(Li2CO3:73.89)を含む.
製法 本品は「炭酸リチウム」をとり,錠剤の製法により製す
45
る.
46
確認試験
47
(1)本品を粉末とし,炎色反応試験(1) 〈1.04〉 を行うとき,
48
持続する赤色を呈する.
49
(2)本品を粉末とし,「炭酸リチウム」0.2 gに対応する量
50
をとり,希塩酸3 mLを加えてよく振り混ぜ,水を加えて20
51
mLとし,ろ過する.ろ液5 mLに水酸化ナトリウム試液2
52
mL及びリン酸水素二ナトリウム試液2 mLを加えて加温した
53
後,冷却するとき,白色の沈殿を生じる.この沈殿は希塩酸
54
2 mLを追加するとき,溶ける.
55
(3)本品を粉末とし,「炭酸リチウム」0.5 gに対応する量
56
をとり,水50 mLを加えてよく振り混ぜた後,ろ過した液は
57
炭酸塩の定性反応〈1.09〉を呈する.
58
製剤均一性〈6.02〉 質量偏差試験を行うとき,適合する.
59
溶出性〈6.10〉 試験液に水900 mLを用い,パドル法により,
60
毎分100回転で試験を行うとき,100 mg錠の15分間及び180
61
分間の溶出率はそれぞれ45%以下及び80%以上であり,200
62
mg錠の30分間及び180分間の溶出率はそれぞれ50%以下及
63
び80%以上である.
64
本品1個をとり,試験を開始し,規定された時間にそれぞ
65
れ溶出液20 mLを正確にとり,直ちに37±0.5℃に加温した
21
なお,三薬局方で調和されていない部分のうち,調和合意におい
22
66
水20 mLを正確に注意して補う.溶出液は孔径0.45 μm以下
て,調和の対象とされた項中非調和となっている項の該当箇所は
23
67
のメンブランフィルターでろ過する.初めのろ液10 mL以上
「
24
68
を除き,次のろ液V mLを正確に量り,希塩酸5 mLを正確に
することとした項は「
◆
◆
」で,調和の対象とされた項以外に日本薬局方が独自に規定
◇
」で囲むことにより示す.
69
加え,1 mL中に炭酸リチウム(Li2CO3)約4.4 μgを含む液と
70
なるように水を加えて正確にV ´ mLとし,試料溶液とする.
71
別に定量用炭酸リチウムを105℃で3時間乾燥し,その約22
72
mgを精密に量り,水に溶かし,正確に100 mLとする.この
本品約1 gを精密に量り,希塩酸20 mLを加
73
液0.5 mL,2 mL,3 mL,4 mL 及び 5 mLをそれぞれ正確
29
え,50℃で15分間かき混ぜながら加温し,冷後,水を加え
74
に量り,水を加えてそれぞれ正確に20 mLとする.これらの
30
て正確に50 mLとし,ろ過する.必要ならば澄明になるまで
75
液5 mLを正確に量り,希塩酸5 mLを正確に加え,更に水を
遠心分離し,この液25 mLをとり,希硫酸1 mLを加えて蒸
76
加えてそれぞれ正確に50 mLとし,標準溶液(1),標準溶液
32
発乾固し,800±25℃で恒量になるまで強熱するとき,その
77
(2),標準溶液(3),標準溶液(4)及び標準溶液(5)とする.試料
33
量は2.0%以下である.◇
78
溶液及び標準溶液につき,次の条件で原子吸光光度法
79
〈2.23〉 により試験を行い,吸光度 AT(n) , AS1 , AS2 , AS3 ,
同条純度試験の項(8)の目を削る.
80
AS4及びAS5を測定し,標準溶液の濃度と吸光度の関係から得
81
た検量線を用いて溶出率(%)を求める.
25
三薬局方の調和合意に関する情報については,独立行政法人医薬
26
品医療機器総合機構のウェブサイトに掲載している.
27
純度試験
28
◇
31
34
◇
(2)
酸可溶物
日本薬局方の医薬品の適否は,その医薬品各条の規定,通則,生薬総則,製剤総則及び一般試験法の規定によって判定する.(通則5参照 )