提案書05(0802頁~0998頁)医療技術評価・再評価提案書 (47 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000190899_00011.html |
| 出典情報 | 中央社会保険医療協議会 診療報酬調査専門組織・医療技術評価分科会(令和5年度第1回 11/20)《厚生労働省》 |
ページ画像
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
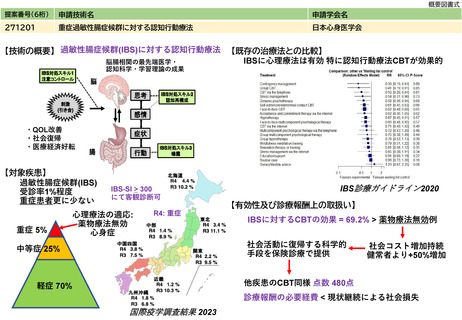
※下記のように推定した根拠
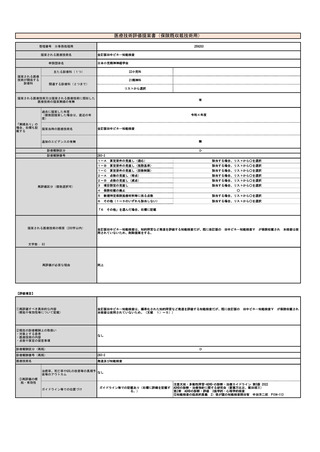
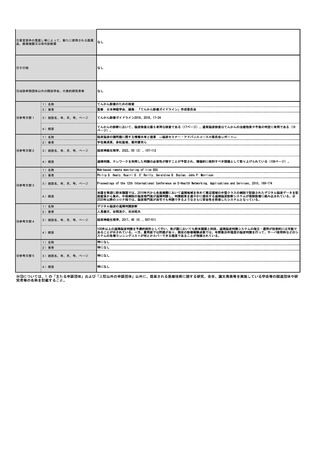
年間対象者数の
変化
年間実施回数の
変化等
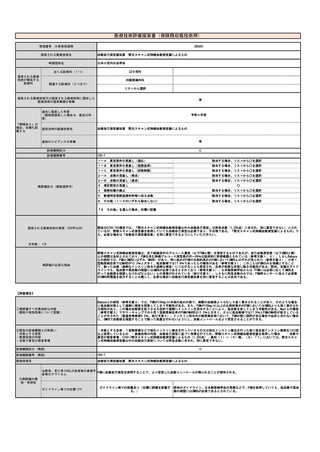
見直し前の症例数(人)
約80人
見直し後の症例数(人)
約80人
見直し前の回数(回)
12回
見直し後の回数(回)
12回
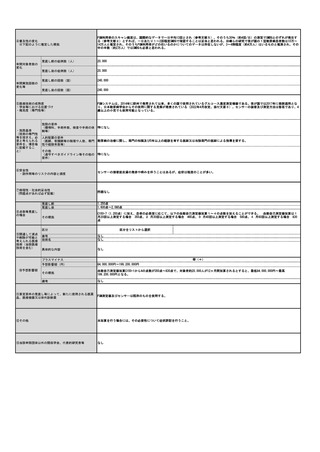
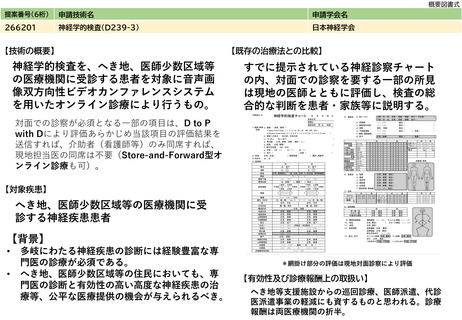
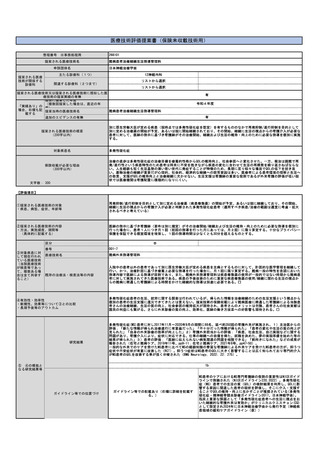
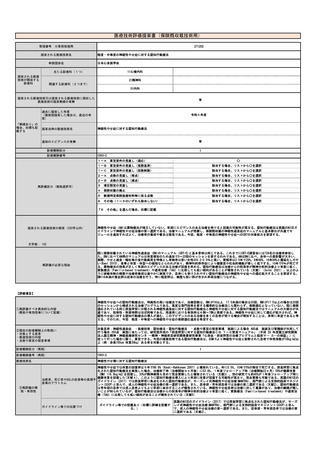
⑤医療技術の成熟度
・学会等における位置づけ
・難易度(専門性等)
・施設基準
(技術の専門性
等を踏まえ、必
要と考えられる
要件を、項目毎
に記載するこ
と)
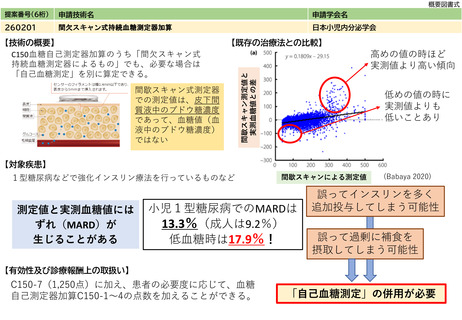
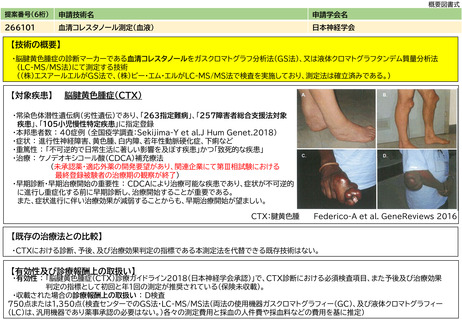
アバタセプト製剤を販売しているブリストル・マイヤーズスクイブ社の製造販売後調査の結果をもとに、症例数を下記と判断した。
既存治療で効果不十分な多関節に活動性を有する若年性特発性関節炎に対し、アバタセプト製剤の投与は、「若年性特発性関節炎における生物学
的製剤使用の手引き2020年版」に記載の通り、トシリズマブ製剤と同様に行われ、点滴投与は通知第37外来化学療法加算に示される施設基
準を満たした施設ですでに広く行われている。アバタセプト製剤の投与時に管理・観察が必要な項目は、主にアナフィラキシーをはじめとしたア
レルギー、投与時反応であり、管理方法やその難易度の点において、すでに化学療法加算の認められたトシリズマブ製剤と差は無い。投与時間も
同等である。
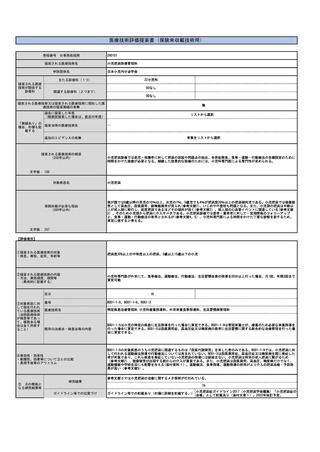
施設の要件
通知第37外来化学療法加算に定められた基準を満たした施設で、外来化学療法を実施するための専用ベッド等を用いる。これは既に行われてい
(標榜科、手術件数、検査や手術の体 ると考えられ、施設にさらなる負担をかけるものでは無い。
制等)
人的配置の要件
通知第37外来化学療法加算に定められた基準を満たした施設で、外来化学療法を実施するための専任の常勤医師、看護師、常勤薬剤師の設置が
(医師、看護師等の職種や人数、専門 必要であるが、すでに広くこの診療体制は行われていると考えられ、新たな人事配置要件が生じると考えられない。
性や経験年数等)
その他
(遵守すべきガイドライン等その他の 特になし
要件)
⑥安全性
・副作用等のリスクの内容と頻度
特になし
⑦倫理性・社会的妥当性
(問題点があれば必ず記載)
特になし
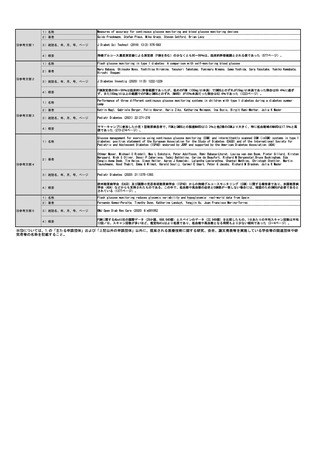
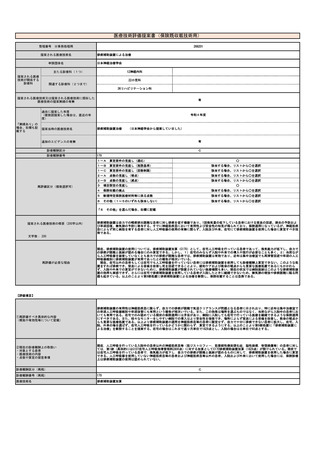
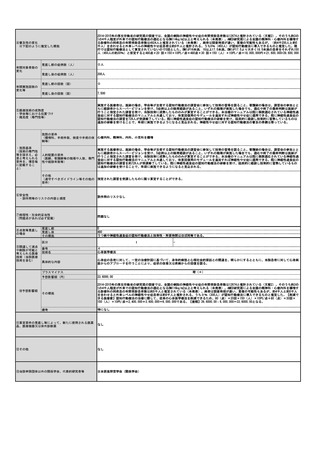
⑧点数等見直し
の場合
見直し前
加算無し
見直し後
現行のイ、外来化学療法加算1(15歳未満670点、以上450点)とロ、外来化学療法加算2(15歳未満640点、以上370点)を算定する
その根拠
トシリズマブ製剤と同一とする、および関節リウマチと同等とする。
区分
⑨関連して減点
や削除が可能と
考えられる医療
技術(当該医療
技術を含む)
特になし
区分をリストから選択
番号
技術名
特になし
特になし
具体的な内容
特になし
増(+)
プラスマイナス
⑩予想影響額
予想影響額(円)
年間3,700,000円〜6,700,000円
その根拠
約80名の年間12回投与、加算を1回あたり370点〜670点として算出
備考
なし
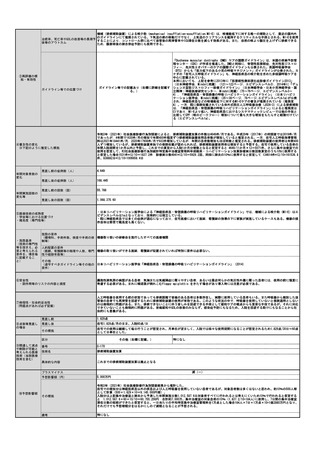
⑪算定要件の見直し等によって、新たに使用される医薬
品、医療機器又は体外診断薬
オレンシア点滴静注用 250mg
⑫その他
特になし
⑬当該申請団体以外の関係学会、代表的研究者等
特になし
848