よむ、つかう、まなぶ。
資料2-①全ゲノム解析等に係る事業実施準備室の検討状況 (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_35569.html |
| 出典情報 | 厚生科学審議会 科学技術部会全ゲノム解析等の推進に関する専門委員会(第17回 10/3)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
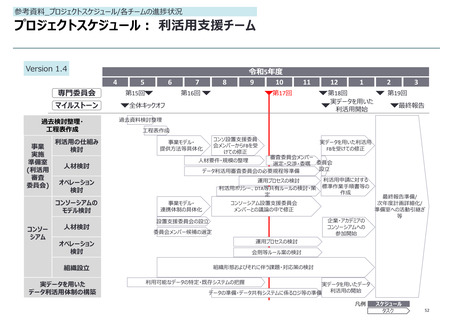
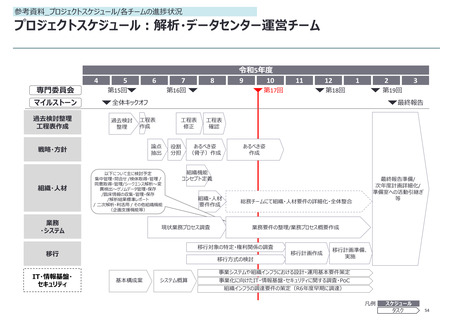
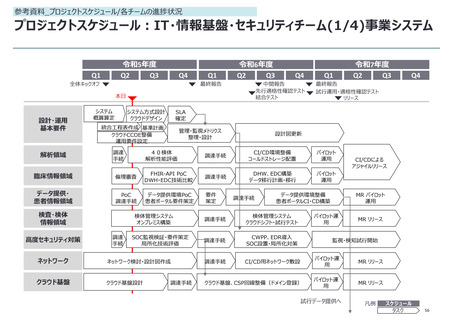
参考資料_各報告事項の補足資料
A
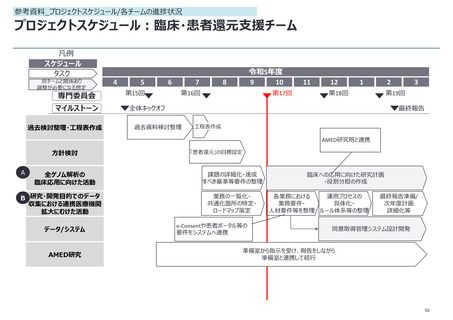
【補足資料:臨床・患者還元支援チーム】全ゲノム解析の検査として臨床への
応用にむけた戦略
•
全ゲノム解析を臨床検査として保険適用するための前提条件を整理
検出すべき所見(異常)が多岐に渡り、精度管理
することが困難であるため薬事承認にはそぐわない
詳細
要旨
先行対象
候補疾患
• 難病
• がん(遺伝性、小児、希少、原発不明)、戦略コホートでエビデンスが出たもの
臨床検査として
取れる選択肢
• 検査システム、キット、試薬として薬事承認は非現実的
• Lab developed test (LDT)として、質が保証された医療機関や衛生検査所の検査室において実施が現実的
質を保証する
ための仕組み
• ISO15189は遺伝子を扱う臨床検査室としては良いが、全ゲノム解析検査には不十分
• 米国ではCLIA(Clinical Laboratory Improvement Amendments)認定及びCAP(College of
American Pathologists)によるLaboratory Accreditation Program認定を受けた商用ラボで実施
• CLIA,CAP認定が直接認められない場合には衛生検査所の上乗せ要件を要策定
補足:国内では日本臨床検査標準協議会
が国内の臨床検査室を認定
(参考)AMED薬品等規制調和・評価研究事業「遺伝子パネル検査によるコンパニオン診断
システムの標準化に向けた検討」(研究代表者:永井純正):
産官学からなる班会議構成員により、遺伝子パネル検査に関する留意点を取りまとめた例
41
A
【補足資料:臨床・患者還元支援チーム】全ゲノム解析の検査として臨床への
応用にむけた戦略
•
全ゲノム解析を臨床検査として保険適用するための前提条件を整理
検出すべき所見(異常)が多岐に渡り、精度管理
することが困難であるため薬事承認にはそぐわない
詳細
要旨
先行対象
候補疾患
• 難病
• がん(遺伝性、小児、希少、原発不明)、戦略コホートでエビデンスが出たもの
臨床検査として
取れる選択肢
• 検査システム、キット、試薬として薬事承認は非現実的
• Lab developed test (LDT)として、質が保証された医療機関や衛生検査所の検査室において実施が現実的
質を保証する
ための仕組み
• ISO15189は遺伝子を扱う臨床検査室としては良いが、全ゲノム解析検査には不十分
• 米国ではCLIA(Clinical Laboratory Improvement Amendments)認定及びCAP(College of
American Pathologists)によるLaboratory Accreditation Program認定を受けた商用ラボで実施
• CLIA,CAP認定が直接認められない場合には衛生検査所の上乗せ要件を要策定
補足:国内では日本臨床検査標準協議会
が国内の臨床検査室を認定
(参考)AMED薬品等規制調和・評価研究事業「遺伝子パネル検査によるコンパニオン診断
システムの標準化に向けた検討」(研究代表者:永井純正):
産官学からなる班会議構成員により、遺伝子パネル検査に関する留意点を取りまとめた例
41