よむ、つかう、まなぶ。
資料1-2 チェストベリー乾燥エキスのリスク評価について (8 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_24102.html |
| 出典情報 | 薬事・食品衛生審議会 薬事分科会医薬品等安全対策部会安全対策調査会(第29回 2/28)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
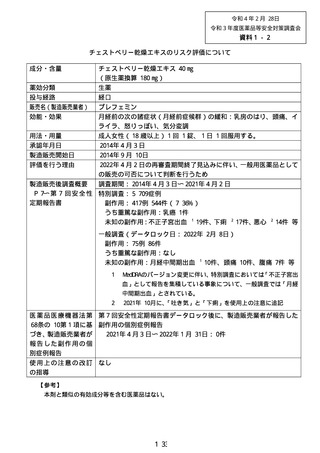
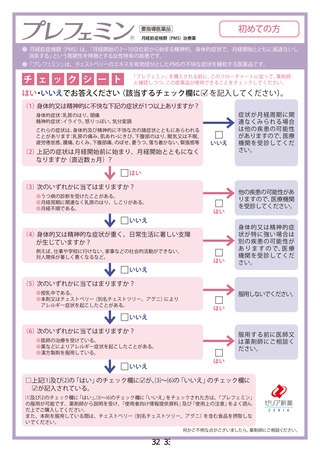
別紙様式第 1
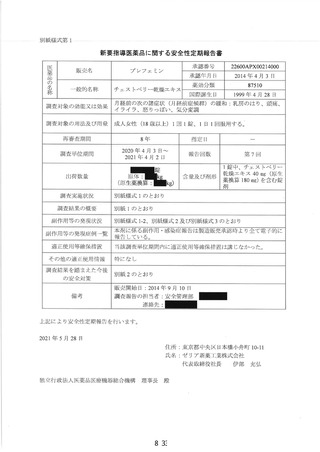
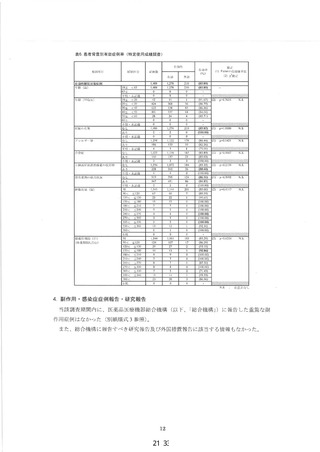
新妥指導医薬品に関する安全性定期報告書
認番呈 22600APX00214000
了 販売名 プレフェミン で陸て
で 承認年月日 2014 年4月3日
の ms
楽効分類 87510
一般的名称 チェストベリーー乾燥エキス
共 ー 時 国際誕生日 1999 年4 月 28 日
間 PP 月経前の次の諸症状 (月経前症候群) の緩和 : 乳房のはり、頭痛、
胃容対象の効能は効果 | イライラ、色りっぱぽい、和気分変調
調査対象の用法及び用量 | 成人女性 (18 歳以上) 1 回 1 錠、1 日 1回服用する。
再審査期間 8 年 指定日 ー
ー 2020 年 4 月 3 日 」
調査単位期間 2021 年4月 2 日 報告回数第 7 回
1 錠中、チェストベリー
r 下 スム呈7Nag | 束燥エキス 40 mg (原生
出荷数量 | 量及び剤形 薬換算 180 mg) を含む錠
剤
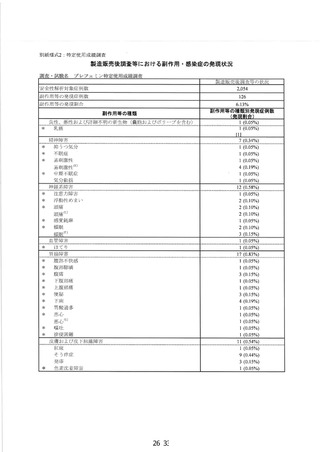
調査実施状況 別紙様式 1 のとおり
調査結果の概要 別紙1 のとおり
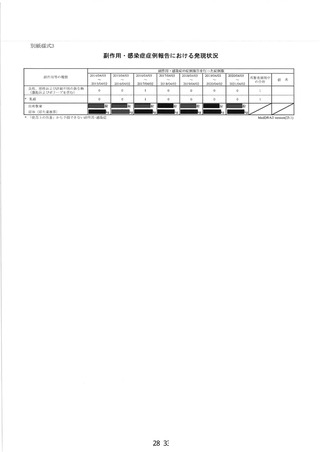
副作用等の発現状況
別紙様式 1.2、別紙様式 2 及び別紙様式 3 のとおり
副作用等の発現症例一覧
本剤に係る副作用・感染症報告は製造販売承認時より全て電子的に
報告している。
適正使用等確保措置 | 当該調査単位期間内に適正使用等確保措置は講じなかった。
その他の適正使用情報 | 符になし
調査結果を踏まえた今後 | . 」
の安全対策 別紙 2 のとおり
販売開始日 : 2014 年9月 10 日
備考 調査報告の担当者 : 安全管理部 請請譲
た 還
上記により安全性定期報告を行います。
2021 年3月 28 日
住所 : 東京都中央区日本橋小舟町 10-11
氏名 : ゼリア新楽工業株式会社
代表取締役社長 伊部 充弘
独立行政法人医薬品医療機器総合機構 理事長 左
6 つづ
8/33
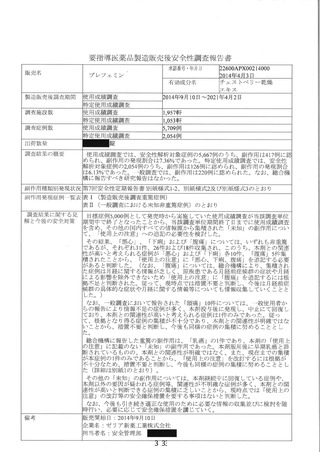
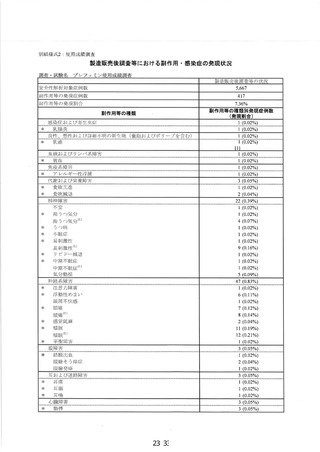
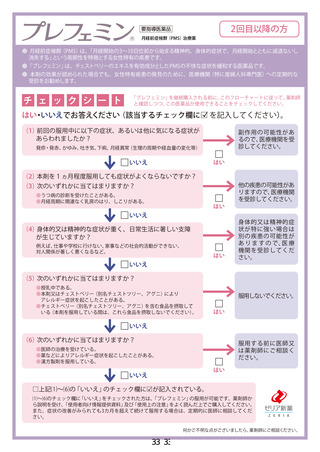
新妥指導医薬品に関する安全性定期報告書
認番呈 22600APX00214000
了 販売名 プレフェミン で陸て
で 承認年月日 2014 年4月3日
の ms
楽効分類 87510
一般的名称 チェストベリーー乾燥エキス
共 ー 時 国際誕生日 1999 年4 月 28 日
間 PP 月経前の次の諸症状 (月経前症候群) の緩和 : 乳房のはり、頭痛、
胃容対象の効能は効果 | イライラ、色りっぱぽい、和気分変調
調査対象の用法及び用量 | 成人女性 (18 歳以上) 1 回 1 錠、1 日 1回服用する。
再審査期間 8 年 指定日 ー
ー 2020 年 4 月 3 日 」
調査単位期間 2021 年4月 2 日 報告回数第 7 回
1 錠中、チェストベリー
r 下 スム呈7Nag | 束燥エキス 40 mg (原生
出荷数量 | 量及び剤形 薬換算 180 mg) を含む錠
剤
調査実施状況 別紙様式 1 のとおり
調査結果の概要 別紙1 のとおり
副作用等の発現状況
別紙様式 1.2、別紙様式 2 及び別紙様式 3 のとおり
副作用等の発現症例一覧
本剤に係る副作用・感染症報告は製造販売承認時より全て電子的に
報告している。
適正使用等確保措置 | 当該調査単位期間内に適正使用等確保措置は講じなかった。
その他の適正使用情報 | 符になし
調査結果を踏まえた今後 | . 」
の安全対策 別紙 2 のとおり
販売開始日 : 2014 年9月 10 日
備考 調査報告の担当者 : 安全管理部 請請譲
た 還
上記により安全性定期報告を行います。
2021 年3月 28 日
住所 : 東京都中央区日本橋小舟町 10-11
氏名 : ゼリア新楽工業株式会社
代表取締役社長 伊部 充弘
独立行政法人医薬品医療機器総合機構 理事長 左
6 つづ
8/33