よむ、つかう、まなぶ。
【参考1】診療の手引き・第8.1版 (53 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/seisakunitsuite/bunya/0000121431_00332.html |
| 出典情報 | 「新型コロナウイルス感染症 COVID-19)診療の手引き・第8.1版」の周知について(10/5付 事務連絡)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
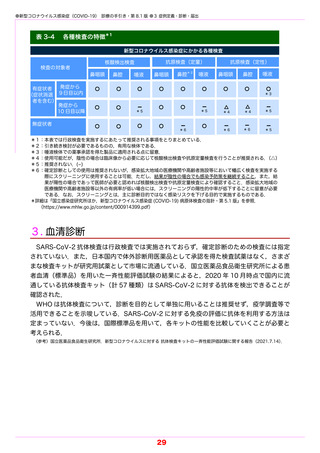
●新型コロナウイルス感染症(COVID-19) 診療の手引き・第 8.1 版 ●5 薬物療法
【カシリビマブ/イムデビマブ】(中和抗体薬) 2021.7.19 特例承認
本剤はオミクロン株(B1.1.529 系統 /BA.2 系統,BA.4 系統および BA.5 系統)に対し
て有効性が減弱するおそれがあることから,他の治療薬が使用できない場合に本剤の投与を
検討すること.
本剤は,単一の抗体産生細胞に由来するクローンから得られた SARS-CoV-2 スパイク蛋白
の受容体結合ドメインに対するモノクローナル抗体であり,SARS-CoV-2 に対して抗ウイル
ス作用を発揮することが期待されている中和抗体薬である.中和抗体薬は,
発症から時間の経っ
ていない軽症例ではウイルス量の減少や重症化を抑制する効果が示されている.また,同居家
族などの濃厚接触者や無症状病原体保有者における発症抑制効果もある.
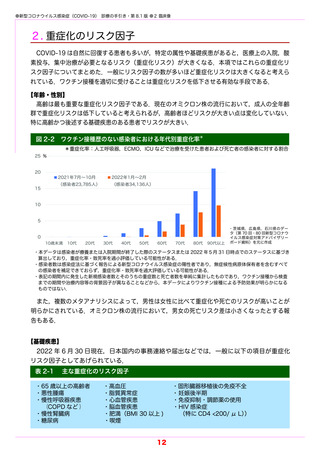
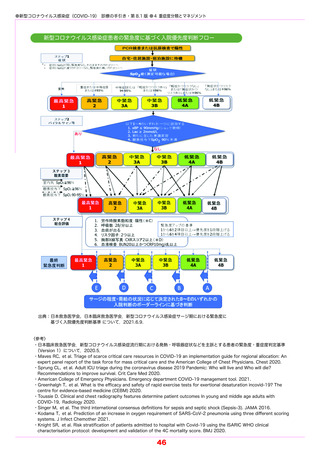
重症化リスク因子(表 5-2 参照)を 1 つ以上もつ COVID-19 外来患者を対象としたランダ
ム化比較試験では,入院または死亡に至った被験者の割合は,カシリビマブ/イムデビマブを
各 600 mg 単回投与した群(736 例)において 1.0% であり,プラセボ群(748 例)の 3.2%
と比較して,70.4 % 有意に減少した.
本剤はオミクロン株(B.1.1.529/BA.2 系統,BA.4 系統および BA.5 系統)に対して有効
性が減弱するおそれがあることから,他の治療薬が使用できない場合に本剤の投与を検討する
こととされている.なお,SARS-CoV-2 による感染症の発症抑制については,同様の対象者
に使用可能な他の治療薬がないことから,慎重に投与を検討すること.
〔投与方法(用法・用量)〕
通常,成人および 12 歳以上かつ体重 40 kg 以上の小児には,カシリビマブ(遺伝子組換え)
およびイムデビマブ(遺伝子組換え)としてそれぞれ 600 mg を併用により単回点滴静注する.
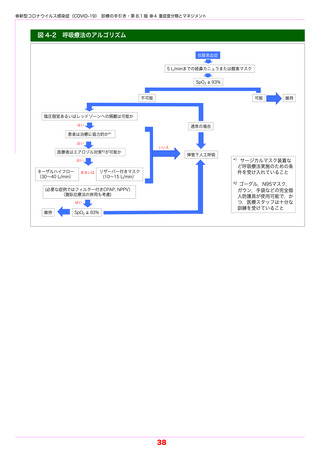
〔発症後投与時の注意点〕
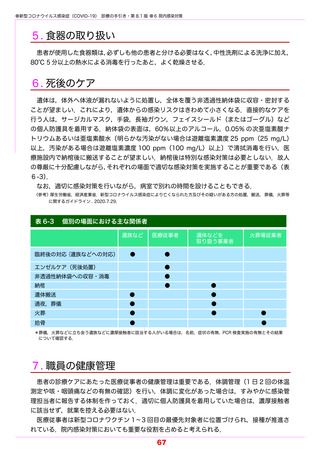
1) 臨床試験における主な投与経験を踏まえ,SARS-CoV-2 による感染症の重症化リスク因子
を有し,酸素投与を要しない患者(本手引きにおける「軽症から中等症Ⅰ」
)を対象に投与を
行うこと.
2) 高流量酸素または人工呼吸器管理を要する患者において症状が悪化したとの報告がある.
3) 本剤の中和活性が低い SARS-CoV-2 変異株に対しては本剤の有効性が期待できない可能性
があるため,SARS-CoV-2 の最新の流行株の情報を踏まえ,本剤投与の適切性を検討すること.
4) SARS-CoV-2 による感染症の症状が発現してから速やかに投与すること.臨床試験において,
症状発現から 8 日目以降に投与を開始した患者における有効性を裏づけるデータは得られてい
ない.
5) 新型コロナワクチンの被接種者は臨床試験で除外されているため,ブレイクスルー感染での重
症化予防などの有効性を裏づけるデータは得られていない.
6) 本剤の投与中は患者をモニターするとともに,投与完了後少なくとも 1 時間は観察する.また,
アナフィラキシーや急性輸注反応を含む重篤な過敏症が,投与中から投与 24 時間後にかけて
起きることがある.
〔入手方法〕
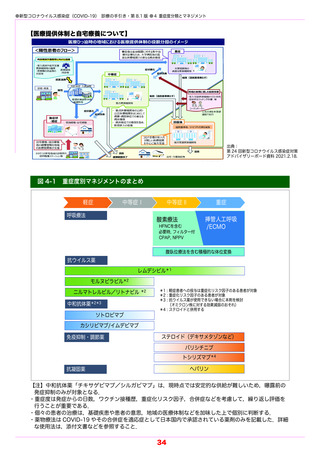
本剤は当初投与対象が入院患者に限定されていたが,条件付きで医療機関の外来や「臨時の
医療施設」等でない宿泊療養施設・入院待機施設,往診での投与が可能となった.
https://www.mhlw.go.jp/content/000836895.pdf
53
【カシリビマブ/イムデビマブ】(中和抗体薬) 2021.7.19 特例承認
本剤はオミクロン株(B1.1.529 系統 /BA.2 系統,BA.4 系統および BA.5 系統)に対し
て有効性が減弱するおそれがあることから,他の治療薬が使用できない場合に本剤の投与を
検討すること.
本剤は,単一の抗体産生細胞に由来するクローンから得られた SARS-CoV-2 スパイク蛋白
の受容体結合ドメインに対するモノクローナル抗体であり,SARS-CoV-2 に対して抗ウイル
ス作用を発揮することが期待されている中和抗体薬である.中和抗体薬は,
発症から時間の経っ
ていない軽症例ではウイルス量の減少や重症化を抑制する効果が示されている.また,同居家
族などの濃厚接触者や無症状病原体保有者における発症抑制効果もある.
重症化リスク因子(表 5-2 参照)を 1 つ以上もつ COVID-19 外来患者を対象としたランダ
ム化比較試験では,入院または死亡に至った被験者の割合は,カシリビマブ/イムデビマブを
各 600 mg 単回投与した群(736 例)において 1.0% であり,プラセボ群(748 例)の 3.2%
と比較して,70.4 % 有意に減少した.
本剤はオミクロン株(B.1.1.529/BA.2 系統,BA.4 系統および BA.5 系統)に対して有効
性が減弱するおそれがあることから,他の治療薬が使用できない場合に本剤の投与を検討する
こととされている.なお,SARS-CoV-2 による感染症の発症抑制については,同様の対象者
に使用可能な他の治療薬がないことから,慎重に投与を検討すること.
〔投与方法(用法・用量)〕
通常,成人および 12 歳以上かつ体重 40 kg 以上の小児には,カシリビマブ(遺伝子組換え)
およびイムデビマブ(遺伝子組換え)としてそれぞれ 600 mg を併用により単回点滴静注する.
〔発症後投与時の注意点〕
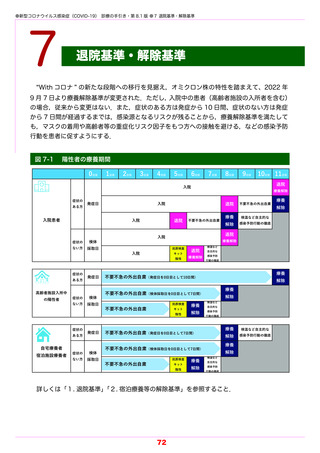
1) 臨床試験における主な投与経験を踏まえ,SARS-CoV-2 による感染症の重症化リスク因子
を有し,酸素投与を要しない患者(本手引きにおける「軽症から中等症Ⅰ」
)を対象に投与を
行うこと.
2) 高流量酸素または人工呼吸器管理を要する患者において症状が悪化したとの報告がある.
3) 本剤の中和活性が低い SARS-CoV-2 変異株に対しては本剤の有効性が期待できない可能性
があるため,SARS-CoV-2 の最新の流行株の情報を踏まえ,本剤投与の適切性を検討すること.
4) SARS-CoV-2 による感染症の症状が発現してから速やかに投与すること.臨床試験において,
症状発現から 8 日目以降に投与を開始した患者における有効性を裏づけるデータは得られてい
ない.
5) 新型コロナワクチンの被接種者は臨床試験で除外されているため,ブレイクスルー感染での重
症化予防などの有効性を裏づけるデータは得られていない.
6) 本剤の投与中は患者をモニターするとともに,投与完了後少なくとも 1 時間は観察する.また,
アナフィラキシーや急性輸注反応を含む重篤な過敏症が,投与中から投与 24 時間後にかけて
起きることがある.
〔入手方法〕
本剤は当初投与対象が入院患者に限定されていたが,条件付きで医療機関の外来や「臨時の
医療施設」等でない宿泊療養施設・入院待機施設,往診での投与が可能となった.
https://www.mhlw.go.jp/content/000836895.pdf
53