よむ、つかう、まなぶ。
03【資料1】新型コロナワクチンの接種について (41 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_27763.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第36回 9/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
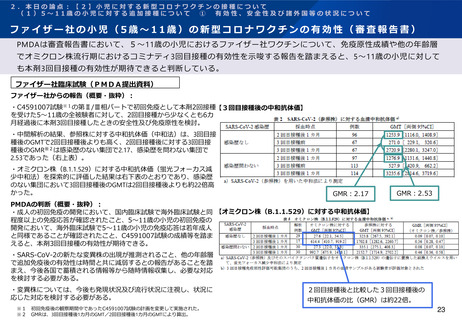
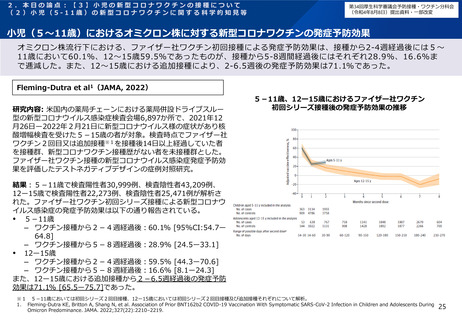
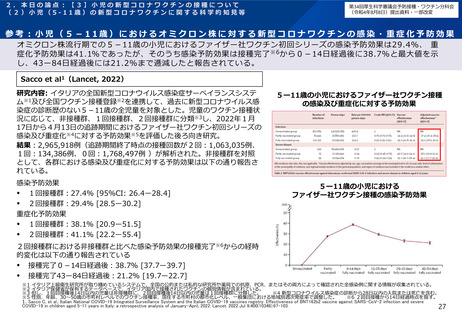
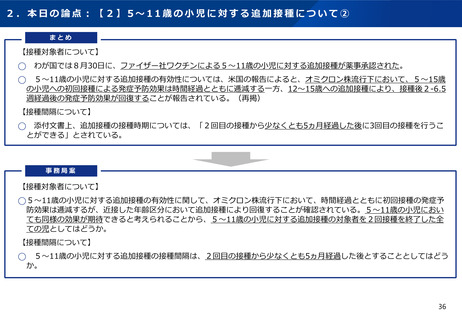
2.本日の論点:【2】小児に対する新型コロナワクチンの接種について
(2)生後6ヶ月~4歳の小児に対する初回接種について ①
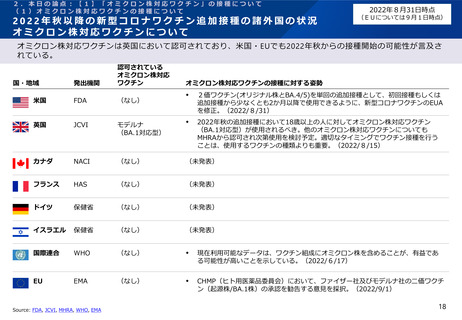
有効性、安全性及び諸外国等の状況について
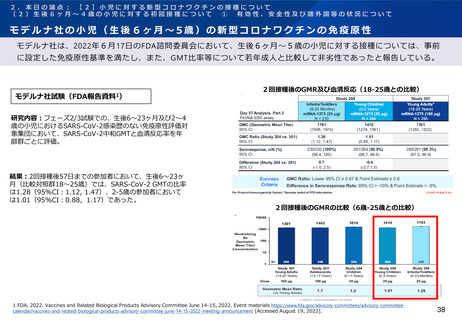
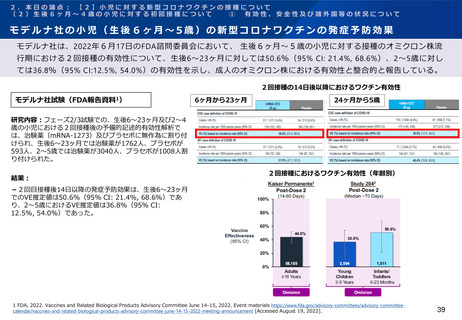
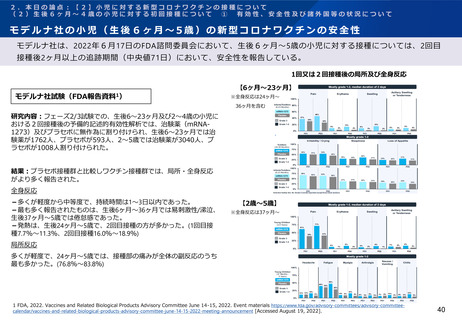
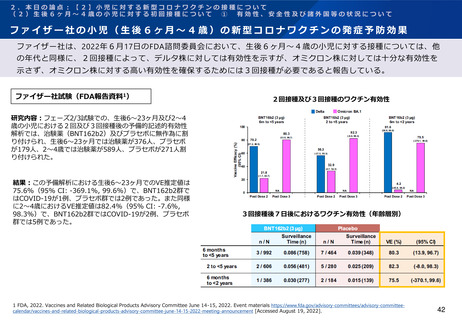
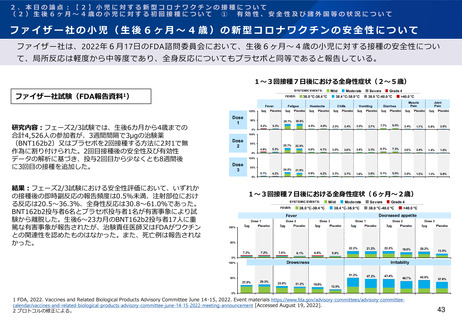
ファイザー社の小児(生後6ヶ月~4歳)の新型コロナワクチンの免疫原性
ファイザー社は、2022年6月17日のFDA諮問委員会において、生後6ヶ月~4歳の小児に対する接種については、2
回接種後の免疫ブリッジングの基準を部分的に満たしたが、3回接種後の免疫ブリッジング基準(若年成人に対する
2回接種後に対するもの)を満たして有効性が示唆されたこと、また3回目接種後のオミクロン株に対する中和抗体
価が高かったことを報告している。
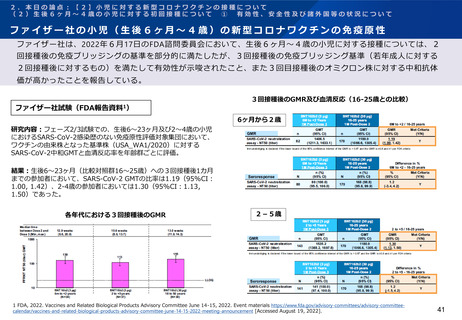
3回接種後のGMR及び血清反応(16-25歳との比較)
ファイザー社試験(FDA報告資料1)
6ヶ月から2歳
研究内容:フェーズ2/3試験での、生後6~23ヶ月及び2~4歳の小児
におけるSARS-CoV-2感染歴のない免疫原性評価対象集団において、
ワクチンの由来株となった基準株(USA_WA1/2020)に対する
SARS-CoV-2中和GMTと血清反応率を年齢群ごとに評価。
結果:生後6~23ヶ月(比較対照群16~25歳)への3回接種後1カ月
までの参加者において、SARS-CoV-2 GMTの比率は1.19(95%CI:
1.00, 1.42)、2-4歳の参加者においては1.30(95%CI:1.13,
1.50)であった。
各年代における3回接種後のGMR
2-5歳
1 FDA, 2022. Vaccines and Related Biological Products Advisory Committee June 14-15, 2022. Event materials https://www.fda.gov/advisory-committees/advisory-committeecalendar/vaccines-and-related-biological-products-advisory-committee-june-14-15-2022-meeting-announcement [Accessed August 19, 2022].
41
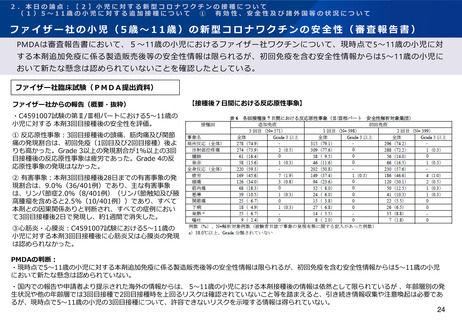
(2)生後6ヶ月~4歳の小児に対する初回接種について ①
有効性、安全性及び諸外国等の状況について
ファイザー社の小児(生後6ヶ月~4歳)の新型コロナワクチンの免疫原性
ファイザー社は、2022年6月17日のFDA諮問委員会において、生後6ヶ月~4歳の小児に対する接種については、2
回接種後の免疫ブリッジングの基準を部分的に満たしたが、3回接種後の免疫ブリッジング基準(若年成人に対する
2回接種後に対するもの)を満たして有効性が示唆されたこと、また3回目接種後のオミクロン株に対する中和抗体
価が高かったことを報告している。
3回接種後のGMR及び血清反応(16-25歳との比較)
ファイザー社試験(FDA報告資料1)
6ヶ月から2歳
研究内容:フェーズ2/3試験での、生後6~23ヶ月及び2~4歳の小児
におけるSARS-CoV-2感染歴のない免疫原性評価対象集団において、
ワクチンの由来株となった基準株(USA_WA1/2020)に対する
SARS-CoV-2中和GMTと血清反応率を年齢群ごとに評価。
結果:生後6~23ヶ月(比較対照群16~25歳)への3回接種後1カ月
までの参加者において、SARS-CoV-2 GMTの比率は1.19(95%CI:
1.00, 1.42)、2-4歳の参加者においては1.30(95%CI:1.13,
1.50)であった。
各年代における3回接種後のGMR
2-5歳
1 FDA, 2022. Vaccines and Related Biological Products Advisory Committee June 14-15, 2022. Event materials https://www.fda.gov/advisory-committees/advisory-committeecalendar/vaccines-and-related-biological-products-advisory-committee-june-14-15-2022-meeting-announcement [Accessed August 19, 2022].
41