よむ、つかう、まなぶ。
資料10 先進医療合同会議の審議結果について【報告事項】 (30 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26038.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第135回 6/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
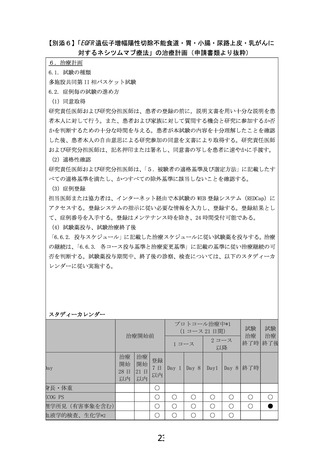
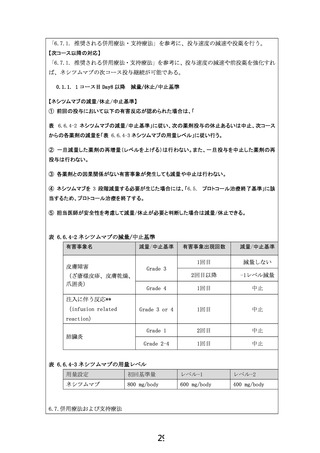
「6.7.1. 推奨される併用療法・支持療法」を参考に、投与速度の減速や投薬を行う。
【次コース以降の対応】
「6.7.1. 推奨される併用療法・支持療法」を参考に、投与速度の減速や前投薬を強化すれ
ば、ネシツムマブの次コース投与継続が可能である。
0.1.1. 1 コース目 Day8 以降
減量/休止/中止基準
【ネシツムマブの減量/休止/中止基準】
① 前回の投与において以下の有害反応が認められた場合は、「
表 6.6.4-2 ネシツムマブの減量/中止基準」に従い、次の薬剤投与の休止あるいは中止、次コース
からの各薬剤の減量を「表 6.6.4-3 ネシツムマブの用量レベル」に従い行う。
② 一旦減量した薬剤の再増量(レベルを上げる)は行わない。また、一旦投与を中止した薬剤の再
投与は行わない。
③ 各薬剤との因果関係がない有害事象が発生しても減量や中止は行わない。
④ ネシツムマブを 3 段階減量する必要が生じた場合には、「6.5. プロトコール治療終了基準」に該
当するため、プロトコール治療を終了する。
⑤ 担当医師が安全性を考慮して減量/休止が必要と判断した場合は減量/休止できる。
表 6.6.4-2 ネシツムマブの減量/中止基準
有害事象名
減量/中止基準
有害事象出現回数
減量/中止基準
1回目
減量しない
2回目以降
-1レベル減量
Grade 4
1回目
中止
Grade 3 or 4
1回目
中止
Grade 1
2回目
中止
Grade 2-4
1回目
中止
皮膚障害
Grade 3
(ざ瘡様皮疹、皮膚乾燥、
爪囲炎)
注入に伴う反応**
(infusion related
reaction)
肺臓炎
表 6.6.4-3 ネシツムマブの用量レベル
用量設定
初回基準量
レベル-1
レベル-2
ネシツムマブ
800 mg/body
600 mg/body
400 mg/body
6.7.併用療法および支持療法
29
【次コース以降の対応】
「6.7.1. 推奨される併用療法・支持療法」を参考に、投与速度の減速や前投薬を強化すれ
ば、ネシツムマブの次コース投与継続が可能である。
0.1.1. 1 コース目 Day8 以降
減量/休止/中止基準
【ネシツムマブの減量/休止/中止基準】
① 前回の投与において以下の有害反応が認められた場合は、「
表 6.6.4-2 ネシツムマブの減量/中止基準」に従い、次の薬剤投与の休止あるいは中止、次コース
からの各薬剤の減量を「表 6.6.4-3 ネシツムマブの用量レベル」に従い行う。
② 一旦減量した薬剤の再増量(レベルを上げる)は行わない。また、一旦投与を中止した薬剤の再
投与は行わない。
③ 各薬剤との因果関係がない有害事象が発生しても減量や中止は行わない。
④ ネシツムマブを 3 段階減量する必要が生じた場合には、「6.5. プロトコール治療終了基準」に該
当するため、プロトコール治療を終了する。
⑤ 担当医師が安全性を考慮して減量/休止が必要と判断した場合は減量/休止できる。
表 6.6.4-2 ネシツムマブの減量/中止基準
有害事象名
減量/中止基準
有害事象出現回数
減量/中止基準
1回目
減量しない
2回目以降
-1レベル減量
Grade 4
1回目
中止
Grade 3 or 4
1回目
中止
Grade 1
2回目
中止
Grade 2-4
1回目
中止
皮膚障害
Grade 3
(ざ瘡様皮疹、皮膚乾燥、
爪囲炎)
注入に伴う反応**
(infusion related
reaction)
肺臓炎
表 6.6.4-3 ネシツムマブの用量レベル
用量設定
初回基準量
レベル-1
レベル-2
ネシツムマブ
800 mg/body
600 mg/body
400 mg/body
6.7.併用療法および支持療法
29