よむ、つかう、まなぶ。
資料10 先進医療合同会議の審議結果について【報告事項】 (20 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26038.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第135回 6/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
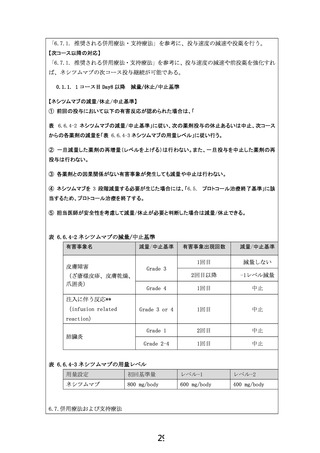
④ 毒性や研究対象者拒否などの理由による化学療法中止例で、後治療として他の治療が加え
られた場合も、治療中止時点や後治療開始日で打ち切りとしない。初回増悪診断日をイベン
トとする。
⑤ 増悪の診断が画像診断による場合、「画像上疑い」の検査日ではなく、後日「確診」が得
られた画像検査の「検査日」をもってイベントとする。
全生存期間(Overall survival: OS)
登録日を起算日とし、あらゆる原因による死亡までの期間。解析を行う時点で生存している
研究対象者や追跡不能例では最終生存確認日を打ち切りとする。
治療成功期間(Time to treatment failure)
① 登録日を起算日とし、あらゆる原因による死亡日、または増悪と診断、または何らかの原
因により治療中止を判断した日のいずれか早い日までの期間とする。
② プロトコール治療終了日は終了と判断した日とする。
③ プロトコール治療中の研究対象者のうち観察期間中の場合は最新の診療日で、研究対象者
追跡期間中で増悪が確認されていない場合は増悪がないことが確認された最終日(最終無増
悪生存確認日)をもって打ち切りとする。
腫瘍制御割合(Disease control rate: DCR)
①CR もしくは PR の定義は「客観的奏効割合」の項参照。
②最良総合効果の SD の判定には、登録時から 6 週時の判定まで総合効果が SD であること
を必要とする。
③最良総合効果が CR、PR、SD となった症例を腫瘍制御と判定し、その割合を腫瘍制御割合
として求めることとする。
※1:非標的病変の CR 判定
すべての非リンパ節非標的病変が消失し、すべてのリンパ節非標的病変の短径が 10 mm 未満
となり、腫瘍マーカー(CEA と CA19-9 に限る)が共用基準範囲上限以下となった場合。
有害事象発生割合
全治療例を分母とし、下記の有害事象(毒性)についてそれぞれ CTCAE v5.0-JCOG による観
察期間中の最悪の Grade の頻度を求める。
- 臨床検査:白血球減少、好中球数減少、貧血(ヘモグロビン)
、血小板数減少、AST 増加、
ALT 増加、ビリルビン増加、クレアチニン増加、高ナトリウム血症、低ナトリウム血症、高カ
リウム血症、低カリウム血症、高カルシウム血症、低カルシウム血症、低アルブミン血症、
低マグネシウム血症、
- 胃腸障害: 口腔粘膜炎、悪心、嘔吐、下痢、便秘、味覚障害
- 一般・全身障害:発熱、食欲不振、疲労、脱毛症
- 感染症:発熱性好中球減少症、感染
- 免疫系障害:皮膚障害:ざ瘡様皮膚炎、皮膚乾燥、そう痒症、爪囲炎、手掌・足底発赤知
覚不全症候群(皮膚亀裂)
、皮膚色素過剰、斑状丘疹状皮
- 呼吸器障害: 肺臓炎
- その他: 動静脈血栓塞栓症、注入に伴う反応(infusion related reaction)
- 上記以外の有害事象については、血液毒性以外の Grade 3 以上の有害事象が観察された
19
られた場合も、治療中止時点や後治療開始日で打ち切りとしない。初回増悪診断日をイベン
トとする。
⑤ 増悪の診断が画像診断による場合、「画像上疑い」の検査日ではなく、後日「確診」が得
られた画像検査の「検査日」をもってイベントとする。
全生存期間(Overall survival: OS)
登録日を起算日とし、あらゆる原因による死亡までの期間。解析を行う時点で生存している
研究対象者や追跡不能例では最終生存確認日を打ち切りとする。
治療成功期間(Time to treatment failure)
① 登録日を起算日とし、あらゆる原因による死亡日、または増悪と診断、または何らかの原
因により治療中止を判断した日のいずれか早い日までの期間とする。
② プロトコール治療終了日は終了と判断した日とする。
③ プロトコール治療中の研究対象者のうち観察期間中の場合は最新の診療日で、研究対象者
追跡期間中で増悪が確認されていない場合は増悪がないことが確認された最終日(最終無増
悪生存確認日)をもって打ち切りとする。
腫瘍制御割合(Disease control rate: DCR)
①CR もしくは PR の定義は「客観的奏効割合」の項参照。
②最良総合効果の SD の判定には、登録時から 6 週時の判定まで総合効果が SD であること
を必要とする。
③最良総合効果が CR、PR、SD となった症例を腫瘍制御と判定し、その割合を腫瘍制御割合
として求めることとする。
※1:非標的病変の CR 判定
すべての非リンパ節非標的病変が消失し、すべてのリンパ節非標的病変の短径が 10 mm 未満
となり、腫瘍マーカー(CEA と CA19-9 に限る)が共用基準範囲上限以下となった場合。
有害事象発生割合
全治療例を分母とし、下記の有害事象(毒性)についてそれぞれ CTCAE v5.0-JCOG による観
察期間中の最悪の Grade の頻度を求める。
- 臨床検査:白血球減少、好中球数減少、貧血(ヘモグロビン)
、血小板数減少、AST 増加、
ALT 増加、ビリルビン増加、クレアチニン増加、高ナトリウム血症、低ナトリウム血症、高カ
リウム血症、低カリウム血症、高カルシウム血症、低カルシウム血症、低アルブミン血症、
低マグネシウム血症、
- 胃腸障害: 口腔粘膜炎、悪心、嘔吐、下痢、便秘、味覚障害
- 一般・全身障害:発熱、食欲不振、疲労、脱毛症
- 感染症:発熱性好中球減少症、感染
- 免疫系障害:皮膚障害:ざ瘡様皮膚炎、皮膚乾燥、そう痒症、爪囲炎、手掌・足底発赤知
覚不全症候群(皮膚亀裂)
、皮膚色素過剰、斑状丘疹状皮
- 呼吸器障害: 肺臓炎
- その他: 動静脈血栓塞栓症、注入に伴う反応(infusion related reaction)
- 上記以外の有害事象については、血液毒性以外の Grade 3 以上の有害事象が観察された
19