よむ、つかう、まなぶ。
資料10 先進医療合同会議の審議結果について【報告事項】 (28 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26038.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第135回 6/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
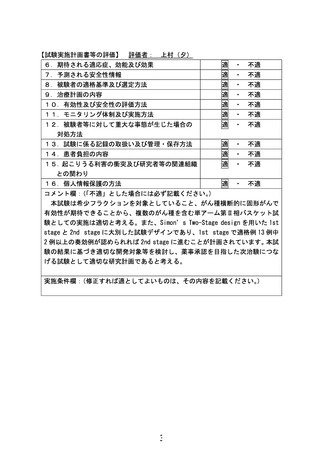
6.5.2. 同意撤回に関する注意
試験参加の同意を得た後、研究対象者本人から研究参加への同意を取り消す申し出があっ
た場合、同意撤回とする。同意撤回とは、研究参加への同意の撤回を意味し、プロトコー
ル治療継続の拒否(下記①)とは区別する。同意の撤回が表明された場合には、下記②か
③のいずれであるかを明確にし、速やかに本試験のデータセンターに連絡すること。
データセンターは②同意撤回の場合は、以降のプロトコールに従ったフォローアップの依
頼を中止する。③の場合は、全同意撤回であることが確認された時点で、当該研究対象者
のデータをデータベースから削除する。
① 研究対象者拒否:以降のプロトコール治療継続の拒否(フォローアップは続ける)
。
② 同意撤回:研究参加への同意を撤回し、以後のプロトコールに従った治療、フォロー
アップのすべてを不可とすること。同意撤回以前のデータの研究利用は可。
③ 全同意撤回:研究参加への同意を撤回し、登録時の情報を含む研究参加時点からのす
べてのデータの研究利用を不可とすること。
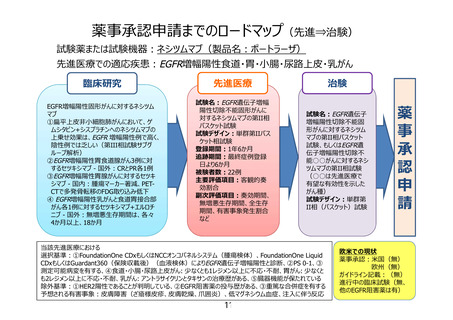
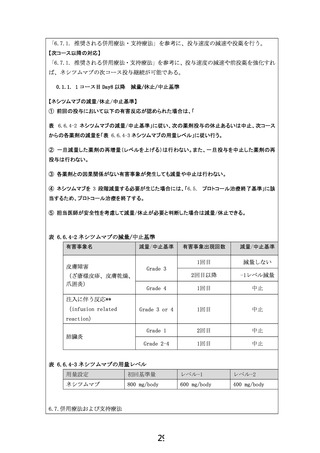
6.6. 試験治療の投与方法
6.6.1. 使用薬剤情報
一般名: ネシツムマブ
商品名: ポートラーザ
剤型・用量:注射剤・800mg 1 瓶
ネシツムマブは、本試験対象に対して「医薬品、医療機器等の品質、有効性および安全性
の確保等に関する法律(医薬品医療機器等法)」上、適応症として承認されておらず保険が
適用されない。そのため、本試験では先進医療(先進医療 B)制度の下での試験となる。こ
のため、予め締結した契約に基づいて、日本化薬株式会社より無償提供を受けて使用する。
薬剤の入手方法・手順は別途「本試験薬の管理に関する手順書」に定める。
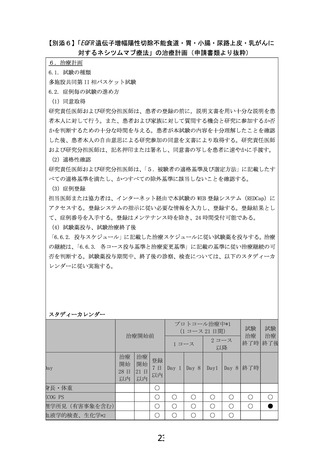
6.6.2. 投与スケジュール
0.1.
Day 1
Day 8
Day 15
休薬
Day 22
(次コース Day 1)
ネシツムマブ
ネシツムマブ: 800 mg(固定量)を day1, 8(day 15 は休薬)
上記を 3 週間毎に繰り返す。
6.6.3. 各コース投与基準と治療変更基準
27
試験参加の同意を得た後、研究対象者本人から研究参加への同意を取り消す申し出があっ
た場合、同意撤回とする。同意撤回とは、研究参加への同意の撤回を意味し、プロトコー
ル治療継続の拒否(下記①)とは区別する。同意の撤回が表明された場合には、下記②か
③のいずれであるかを明確にし、速やかに本試験のデータセンターに連絡すること。
データセンターは②同意撤回の場合は、以降のプロトコールに従ったフォローアップの依
頼を中止する。③の場合は、全同意撤回であることが確認された時点で、当該研究対象者
のデータをデータベースから削除する。
① 研究対象者拒否:以降のプロトコール治療継続の拒否(フォローアップは続ける)
。
② 同意撤回:研究参加への同意を撤回し、以後のプロトコールに従った治療、フォロー
アップのすべてを不可とすること。同意撤回以前のデータの研究利用は可。
③ 全同意撤回:研究参加への同意を撤回し、登録時の情報を含む研究参加時点からのす
べてのデータの研究利用を不可とすること。
6.6. 試験治療の投与方法
6.6.1. 使用薬剤情報
一般名: ネシツムマブ
商品名: ポートラーザ
剤型・用量:注射剤・800mg 1 瓶
ネシツムマブは、本試験対象に対して「医薬品、医療機器等の品質、有効性および安全性
の確保等に関する法律(医薬品医療機器等法)」上、適応症として承認されておらず保険が
適用されない。そのため、本試験では先進医療(先進医療 B)制度の下での試験となる。こ
のため、予め締結した契約に基づいて、日本化薬株式会社より無償提供を受けて使用する。
薬剤の入手方法・手順は別途「本試験薬の管理に関する手順書」に定める。
6.6.2. 投与スケジュール
0.1.
Day 1
Day 8
Day 15
休薬
Day 22
(次コース Day 1)
ネシツムマブ
ネシツムマブ: 800 mg(固定量)を day1, 8(day 15 は休薬)
上記を 3 週間毎に繰り返す。
6.6.3. 各コース投与基準と治療変更基準
27