よむ、つかう、まなぶ。
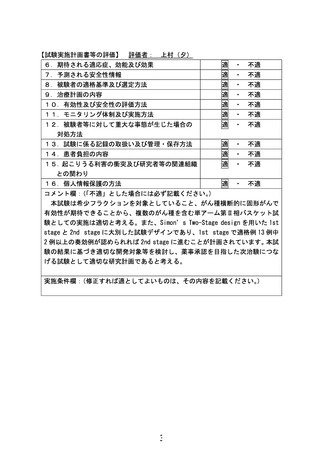
資料10 先進医療合同会議の審議結果について【報告事項】 (11 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26038.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第135回 6/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
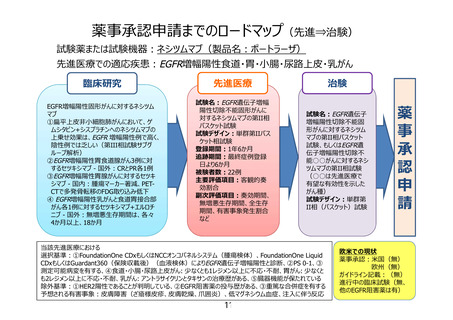
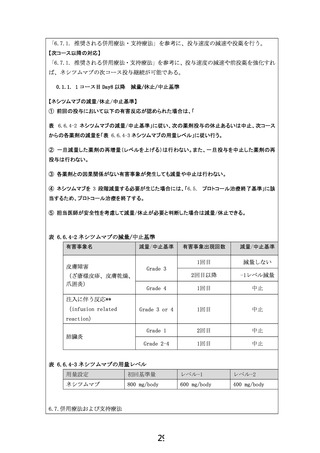
EGFR遺伝子増幅陽性切除不能食道・胃・小腸・
尿路上皮・乳がんに対するネシツムマブ療法
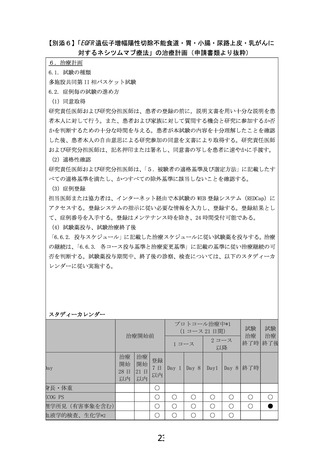
主な適格・除外基準(予定: 22名)
遺伝子パネル検査によりEGFR遺伝子増幅陽性と診断
食道がん・小腸・尿路上皮がんは1レジメン以上、胃がんは2レジメン以上に不応・不耐、
乳がんはアントラサイクリン系・タキサン系抗腫瘍薬による治療歴がある
ECOG Performance Statusが0もしくは1(全身状態が良好である)
RECIST 1.1版に基づく測定可能病変を有する(基準を超える大きさの病変がある)
除外: EGFR(増幅除く)、RAS、BRAF、MAP2K、ERBB2に遺伝子異常を有する
除外: HER2陽性胃・乳がん(IHC 3+もしくはIHC 2+かつISH+)
目的
治療法
ネシツムマブ(注射剤)
800 mg(固定量)を
1日目, 8日目に投与
(15日目は休薬)
上記を3週間毎に繰り返す
EGFR遺伝子増幅陽性固形がんに対するネシツムマブの有効性、安全性を評価する
ネシツムマブがEGFR遺伝子増幅を標的として有効性を示していることを確認する
評価項目
主要評価項目: 確定された奏効割合(腫瘍が30%以上縮小する患者の割合)
試験期間
症例登録期間:18か月、観察期間:6か月
予定症例数
第一段階: 13名(有効であることが確認できない場合は第一段階で終了)
第二段階: 6-9名(第一段階と合わせて計19-22名)
施設数
全国12施設(予定)
10
尿路上皮・乳がんに対するネシツムマブ療法
主な適格・除外基準(予定: 22名)
遺伝子パネル検査によりEGFR遺伝子増幅陽性と診断
食道がん・小腸・尿路上皮がんは1レジメン以上、胃がんは2レジメン以上に不応・不耐、
乳がんはアントラサイクリン系・タキサン系抗腫瘍薬による治療歴がある
ECOG Performance Statusが0もしくは1(全身状態が良好である)
RECIST 1.1版に基づく測定可能病変を有する(基準を超える大きさの病変がある)
除外: EGFR(増幅除く)、RAS、BRAF、MAP2K、ERBB2に遺伝子異常を有する
除外: HER2陽性胃・乳がん(IHC 3+もしくはIHC 2+かつISH+)
目的
治療法
ネシツムマブ(注射剤)
800 mg(固定量)を
1日目, 8日目に投与
(15日目は休薬)
上記を3週間毎に繰り返す
EGFR遺伝子増幅陽性固形がんに対するネシツムマブの有効性、安全性を評価する
ネシツムマブがEGFR遺伝子増幅を標的として有効性を示していることを確認する
評価項目
主要評価項目: 確定された奏効割合(腫瘍が30%以上縮小する患者の割合)
試験期間
症例登録期間:18か月、観察期間:6か月
予定症例数
第一段階: 13名(有効であることが確認できない場合は第一段階で終了)
第二段階: 6-9名(第一段階と合わせて計19-22名)
施設数
全国12施設(予定)
10