よむ、つかう、まなぶ。
資料10 先進医療合同会議の審議結果について【報告事項】 (17 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_26038.html |
| 出典情報 | 先進医療会議 先進医療技術審査部会(第135回 6/16)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
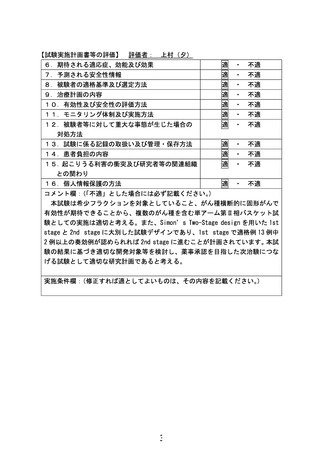
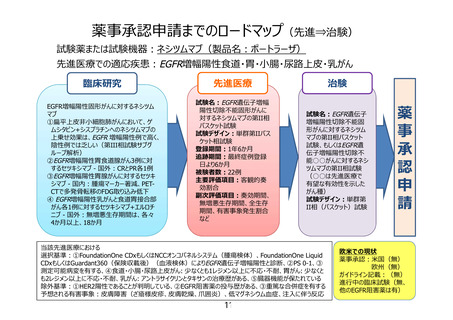
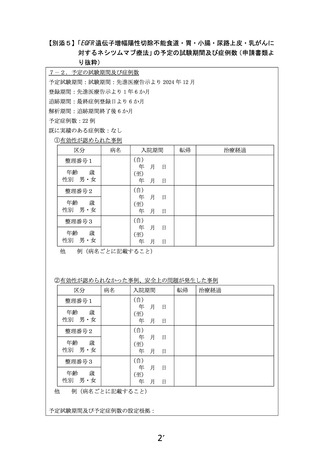
【別添3】
「EGFR 遺伝子増幅陽性切除不能食道・胃・小腸・尿路上皮・乳がんに
対するネシツムマブ療法」の被験者の適格基準及び選定方法(申請書
類より抜粋)
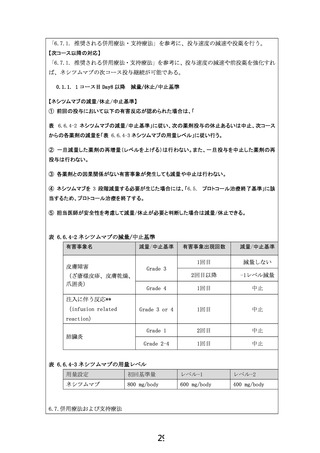
5.被験者の適格基準及び選定方法
候補症例の中で、以下のすべての適格基準を満たし、かつ以下のすべての除外基準に該当し
ない症例を本試験の対象とする。
【適格基準】
1) 本試験登録前に試験内容の十分な説明が行われた後、患者本人から文書による同意が得
られている
2) ctDNA 解析のための血液採取に関して、十分な説明が行われた後、患者本人から文書によ
る同意が得られている
3) 同意取得時の年齢が 20 歳以上である
4) 組織学的もしくは細胞学的に食道・胃・小腸・尿路上皮・乳がんと診断されている
5) 腫瘍検体を用いて FoundationOne CDx もしくは NCC オンコパネルシステムにより、もし
くは血液検体を用いて FoundationOne Liquid CDx もしくは Guardant360*により EGFR 遺伝
子増幅陽性と診断されている。
ただし、FoundationOne CDx と Guardant360 については EGFR 遺伝子増幅陽性と報告され
た場合でも、以下の基準も満たす必要がある。
FoundationOne CDx: copy number ≥ 8(equivocal と判定される、8> copy number ≥ 6
は不適格)
Guardant360: plasma copy number ≥ 4(plasma copy number < 4 は不適格)
*Guardant360 は保険収載された後に対象とする
6) EGFR(増幅除く)
、RAS、BRAF、MAP2K、ERBB2 に遺伝子異常を有さない
7) 切除不能な進行・再発の食道・胃・小腸・尿路上皮・乳がんである
8) 症状を有する中枢神経系(脳、脊髄、髄膜)への転移がない
9) RECIST ガイドライン version 1.1 に基づく測定可能病変を有する
10) 標準治療に不応もしくは不耐である。
食道・小腸・尿路上皮がん: 少なくとも 1 レジメン以上に不応・不耐
胃がん: 少なくとも 2 レジメン以上に不応・不耐
ホルモン受容体陰性乳がん: アンスラサイクリンとタキサンの治療歴がある
ホルモン受容体陽性乳がん: ホルモン療法不応かつアンスラサイクリンとタキサンの治
療歴がある
11) ECOG Performance Status が 0 または 1 である
12) 3 ヶ月以上の生存が期待される
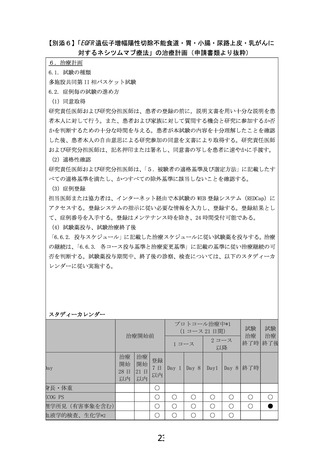
13) 登録前 7 日以内の最新の検査値(登録日の 1 週間前の同一曜日は可)が、以下のすべて
を満たす。ただし、登録用の血液検査前 7 日以内に輸血歴や G-CSF 投与的がないことが必
要である(輸血、G-CSF と同一曜日の検査値は可)
。
① 好中球数≥1,500/mm3
② ヘモグロビン≥8.0 g/dL
16
「EGFR 遺伝子増幅陽性切除不能食道・胃・小腸・尿路上皮・乳がんに
対するネシツムマブ療法」の被験者の適格基準及び選定方法(申請書
類より抜粋)
5.被験者の適格基準及び選定方法
候補症例の中で、以下のすべての適格基準を満たし、かつ以下のすべての除外基準に該当し
ない症例を本試験の対象とする。
【適格基準】
1) 本試験登録前に試験内容の十分な説明が行われた後、患者本人から文書による同意が得
られている
2) ctDNA 解析のための血液採取に関して、十分な説明が行われた後、患者本人から文書によ
る同意が得られている
3) 同意取得時の年齢が 20 歳以上である
4) 組織学的もしくは細胞学的に食道・胃・小腸・尿路上皮・乳がんと診断されている
5) 腫瘍検体を用いて FoundationOne CDx もしくは NCC オンコパネルシステムにより、もし
くは血液検体を用いて FoundationOne Liquid CDx もしくは Guardant360*により EGFR 遺伝
子増幅陽性と診断されている。
ただし、FoundationOne CDx と Guardant360 については EGFR 遺伝子増幅陽性と報告され
た場合でも、以下の基準も満たす必要がある。
FoundationOne CDx: copy number ≥ 8(equivocal と判定される、8> copy number ≥ 6
は不適格)
Guardant360: plasma copy number ≥ 4(plasma copy number < 4 は不適格)
*Guardant360 は保険収載された後に対象とする
6) EGFR(増幅除く)
、RAS、BRAF、MAP2K、ERBB2 に遺伝子異常を有さない
7) 切除不能な進行・再発の食道・胃・小腸・尿路上皮・乳がんである
8) 症状を有する中枢神経系(脳、脊髄、髄膜)への転移がない
9) RECIST ガイドライン version 1.1 に基づく測定可能病変を有する
10) 標準治療に不応もしくは不耐である。
食道・小腸・尿路上皮がん: 少なくとも 1 レジメン以上に不応・不耐
胃がん: 少なくとも 2 レジメン以上に不応・不耐
ホルモン受容体陰性乳がん: アンスラサイクリンとタキサンの治療歴がある
ホルモン受容体陽性乳がん: ホルモン療法不応かつアンスラサイクリンとタキサンの治
療歴がある
11) ECOG Performance Status が 0 または 1 である
12) 3 ヶ月以上の生存が期待される
13) 登録前 7 日以内の最新の検査値(登録日の 1 週間前の同一曜日は可)が、以下のすべて
を満たす。ただし、登録用の血液検査前 7 日以内に輸血歴や G-CSF 投与的がないことが必
要である(輸血、G-CSF と同一曜日の検査値は可)
。
① 好中球数≥1,500/mm3
② ヘモグロビン≥8.0 g/dL
16