よむ、つかう、まなぶ。
○最適使用推進ガイドラインについて-2-1 (13 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/shingi2/0000212500_00148.html |
| 出典情報 | 中央社会保険医療協議会 総会(第522回 6/1)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
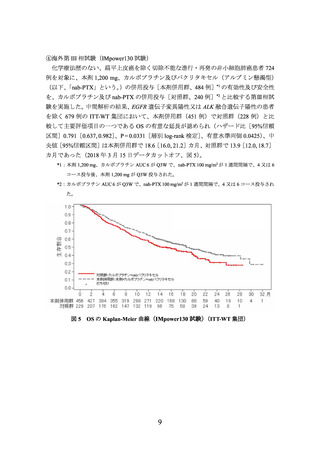
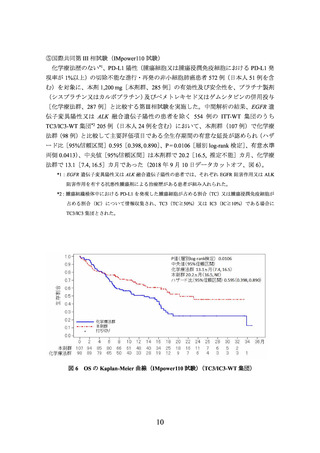
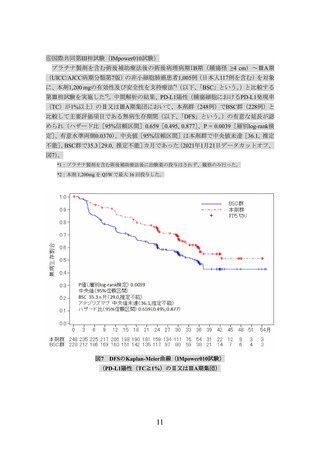
(PD-L1発現状況別の有効性及び安全性)
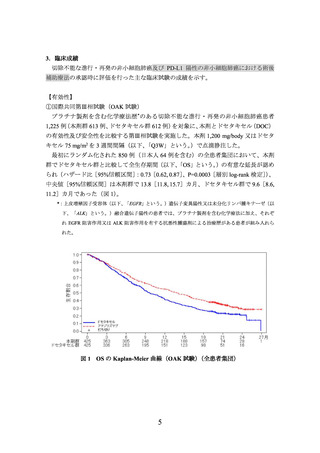
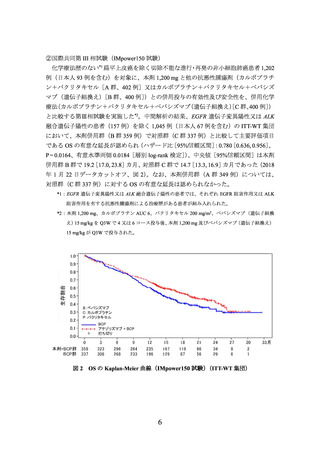
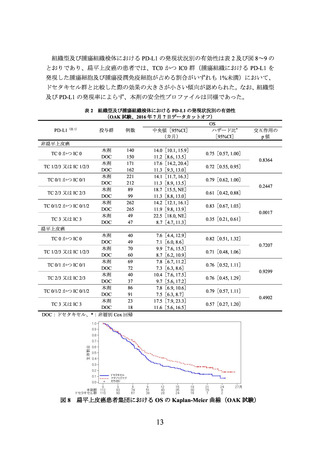
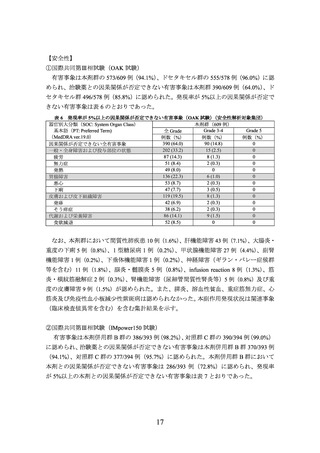
①国際共同第Ⅲ相試験(OAK試験)に組み入れられた患者のうち、腫瘍組織検体におい
てPD-L1を発現した腫瘍細胞及び腫瘍浸潤免疫細胞が占める割合(以下、
「PD-L1発現
率」という。
)に関する情報が得られた一部の患者のデータに基づき、PD-L1発現率等
別に探索的に解析を行った有効性及び安全性の結果は以下のとおりであった。
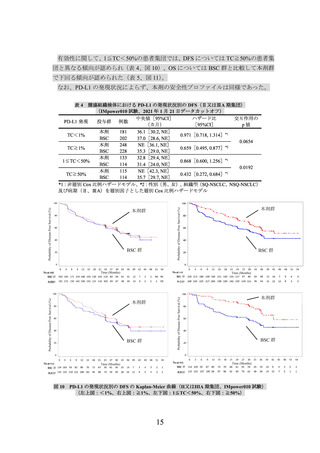
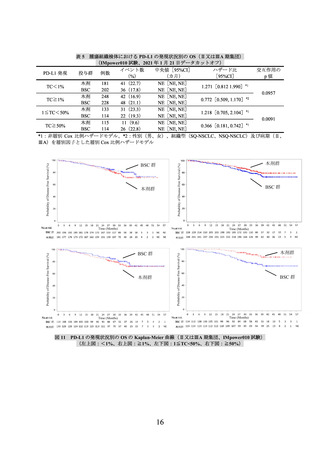
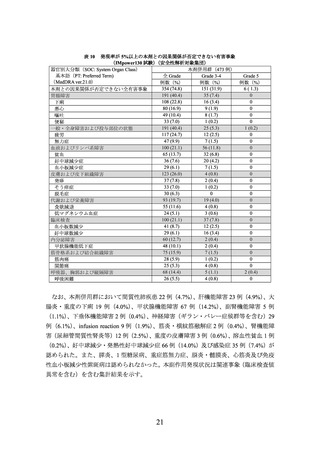
有効性について、PD-L1の発現状況の有効性の結果は、表1のとおりであった。
なお、PD-L1の発現状況によらず、本剤の安全性プロファイルは同様であった。
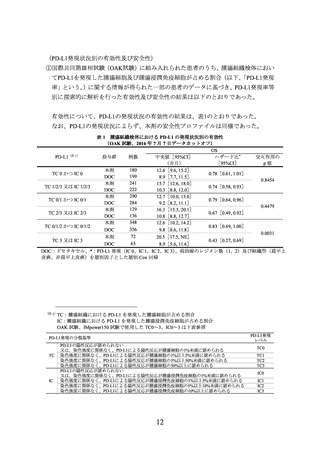
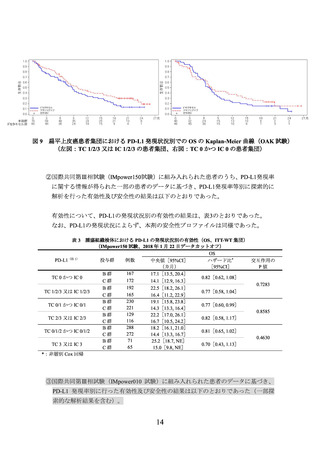
表 1 腫瘍組織検体における PD-L1 の発現状況別の有効性
(OAK 試験、2016 年 7 月 7 日データカットオフ)
OS
PD-L1(注 1)
投与群
例数
中央値[95%CI]
ハザード比*
交互作用の
(カ月)
[95%CI]
p値
180
本剤
12.6[9.6, 15.2]
TC 0 かつ IC 0
0.78[0.61, 1.01]
199
DOC
8.9[7.7, 11.5]
0.8454
241
本剤
15.7[12.6, 18.0]
TC 1/2/3 又は IC 1/2/3
0.74[0.58, 0.93]
222
DOC
10.3[8.8, 12.0]
290
本剤
12.7[10.0, 15.0]
TC 0/1 かつ IC 0/1
0.79[0.64, 0.96]
284
DOC
9.2[8.2, 11.1]
0.4479
129
本剤
16.3[13.3, 20.1]
TC 2/3 又は IC 2/3
0.67[0.49, 0.92]
136
DOC
10.8[8.8, 12.7]
348
本剤
12.6[10.2, 14.2]
TC 0/1/2 かつ IC 0/1/2
0.83[0.69, 1.00]
356
DOC
9.8[8.6, 11.8]
0.0031
72
本剤
20.5[17.5, NE]
TC 3 又は IC 3
0.43[0.27, 0.69]
65
DOC
8.9[5.6, 11.6]
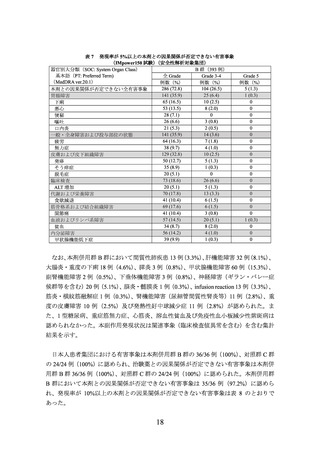
DOC:ドセタキセル、*:PD-L1 発現(IC 0、IC 1、IC 2、IC 3)
、前治療のレジメン数(1、2)及び組織型(扁平上
皮癌、非扁平上皮癌)を層別因子とした層別 Cox 回帰
(注 1)
TC:腫瘍組織における PD-L1 を発現した腫瘍細胞が占める割合
IC:腫瘍組織における PD-L1 を発現した腫瘍浸潤免疫細胞が占める割合
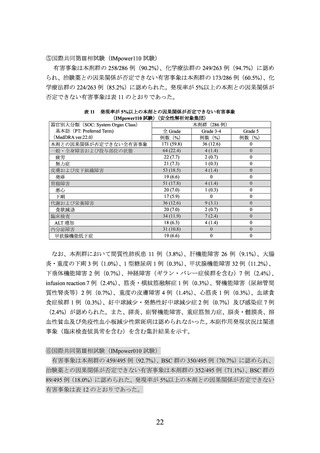
OAK 試験、IMpower150 試験で使用した TC0~3、IC0~3 は下表参照
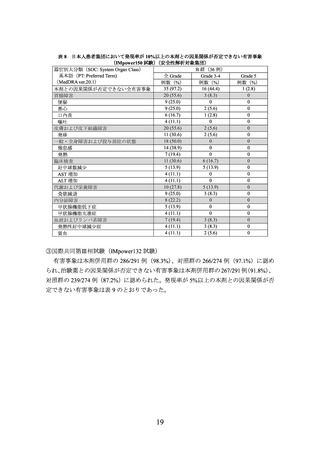
PD-L1発現
レベル
PD-L1発現の分類基準
TC
IC
PD-L1の陽性反応が認められない
又は、染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の1%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の1%以上5%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の5%以上50%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の50%以上に認められる
PD-L1の陽性反応が認められない
又は、染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の1%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の1%以上5%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の5%以上10%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の10%以上に認められる
12
TC0
TC1
TC2
TC3
IC0
IC1
IC2
IC3
①国際共同第Ⅲ相試験(OAK試験)に組み入れられた患者のうち、腫瘍組織検体におい
てPD-L1を発現した腫瘍細胞及び腫瘍浸潤免疫細胞が占める割合(以下、
「PD-L1発現
率」という。
)に関する情報が得られた一部の患者のデータに基づき、PD-L1発現率等
別に探索的に解析を行った有効性及び安全性の結果は以下のとおりであった。
有効性について、PD-L1の発現状況の有効性の結果は、表1のとおりであった。
なお、PD-L1の発現状況によらず、本剤の安全性プロファイルは同様であった。
表 1 腫瘍組織検体における PD-L1 の発現状況別の有効性
(OAK 試験、2016 年 7 月 7 日データカットオフ)
OS
PD-L1(注 1)
投与群
例数
中央値[95%CI]
ハザード比*
交互作用の
(カ月)
[95%CI]
p値
180
本剤
12.6[9.6, 15.2]
TC 0 かつ IC 0
0.78[0.61, 1.01]
199
DOC
8.9[7.7, 11.5]
0.8454
241
本剤
15.7[12.6, 18.0]
TC 1/2/3 又は IC 1/2/3
0.74[0.58, 0.93]
222
DOC
10.3[8.8, 12.0]
290
本剤
12.7[10.0, 15.0]
TC 0/1 かつ IC 0/1
0.79[0.64, 0.96]
284
DOC
9.2[8.2, 11.1]
0.4479
129
本剤
16.3[13.3, 20.1]
TC 2/3 又は IC 2/3
0.67[0.49, 0.92]
136
DOC
10.8[8.8, 12.7]
348
本剤
12.6[10.2, 14.2]
TC 0/1/2 かつ IC 0/1/2
0.83[0.69, 1.00]
356
DOC
9.8[8.6, 11.8]
0.0031
72
本剤
20.5[17.5, NE]
TC 3 又は IC 3
0.43[0.27, 0.69]
65
DOC
8.9[5.6, 11.6]
DOC:ドセタキセル、*:PD-L1 発現(IC 0、IC 1、IC 2、IC 3)
、前治療のレジメン数(1、2)及び組織型(扁平上
皮癌、非扁平上皮癌)を層別因子とした層別 Cox 回帰
(注 1)
TC:腫瘍組織における PD-L1 を発現した腫瘍細胞が占める割合
IC:腫瘍組織における PD-L1 を発現した腫瘍浸潤免疫細胞が占める割合
OAK 試験、IMpower150 試験で使用した TC0~3、IC0~3 は下表参照
PD-L1発現
レベル
PD-L1発現の分類基準
TC
IC
PD-L1の陽性反応が認められない
又は、染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の1%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の1%以上5%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の5%以上50%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍細胞の50%以上に認められる
PD-L1の陽性反応が認められない
又は、染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の1%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の1%以上5%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の5%以上10%未満に認められる
染色強度に関係なく、PD-L1による陽性反応が腫瘍浸潤免疫細胞の10%以上に認められる
12
TC0
TC1
TC2
TC3
IC0
IC1
IC2
IC3
関連画像
ページ内で利用されている画像ファイルです。
有料会員登録をして頂くことで、このページ内で利用されている画像を個別に閲覧・ダウンロードすることができるようになります。