よむ、つかう、まなぶ。
03資料1-1 小児におけるRSウイルス感染症の予防について[2.5MB] (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_70339.html |
| 出典情報 | 厚生科学審議会 予防接種・ワクチン分科会(第64回 2/12)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
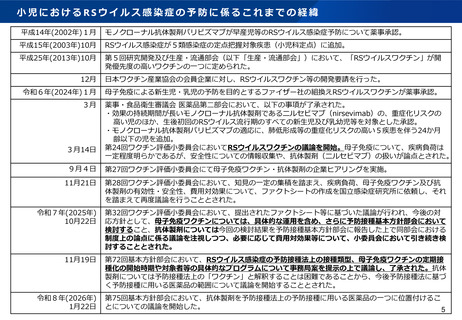
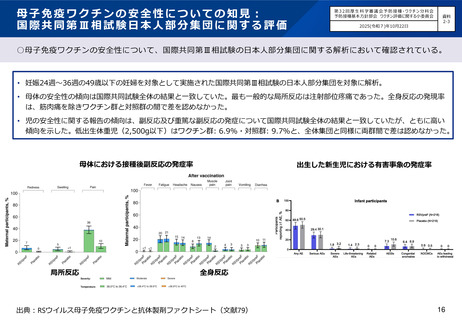
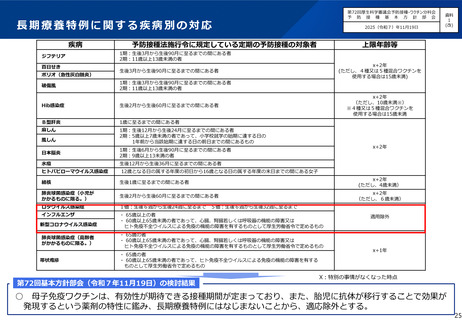
小児におけるRSウイルス感染症の予防に係るこれまでの経緯
平成14年(2002年)1月
モノクローナル抗体製剤パリビズマブが早産児等のRSウイルス感染症予防について薬事承認。
平成15年(2003年)10月
RSウイルス感染症が5類感染症の定点把握対象疾患(小児科定点)に追加。
平成25年(2013年)10月
第5回研究開発及び生産・流通部会(以下「生産・流通部会」)において、「RSウイルスワクチン」が開
発優先度の高いワクチンの一つに定められた。
12月
令和6年(2024年)1月
3月
3月14日
日本ワクチン産業協会の会員企業に対し、RSウイルスワクチン等の開発要請を行った。
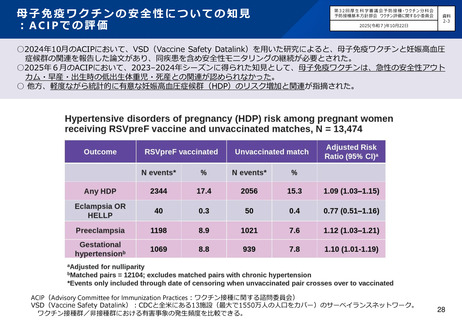
母子免疫による新生児・乳児の予防を目的とするファイザー社の組換えRSウイルスワクチンが薬事承認。
薬事・食品衛生審議会 医薬品第二部会において、以下の事項が了承された。
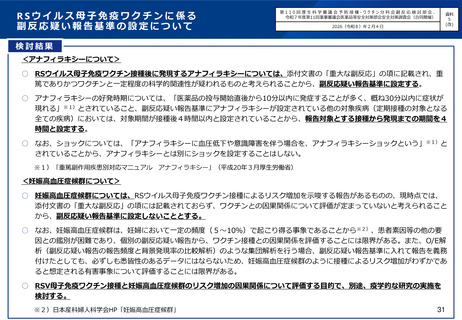
・効果の持続期間が長いモノクローナル抗体製剤であるニルセビマブ(nirsevimab)の、重症化リスクの
高い児のほか、生後初回のRSウイルス流行期のすべての新生児及び乳幼児等を対象とした承認。
・モノクローナル抗体製剤パリビズマブの適応に、肺低形成等の重症化リスクの高い5疾患を伴う24か月
齢以下の児を追加。
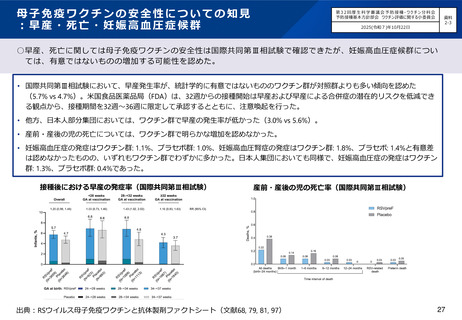
第24回ワクチン評価小委員会においてRSウイルスワクチンの議論を開始。母子免疫について、疾病負荷は
一定程度明らかであるが、安全性についての情報収集や、抗体製剤(ニルセビマブ)の扱いが論点とされた。
9月4日
第27回ワクチン評価小委員会にて母子免疫ワクチン・抗体製剤の企業ヒアリングを実施。
11月21日
第28回ワクチン評価小委員会において、知見の一定の集積を踏まえ、疾病負荷、母子免疫ワクチン及び抗
体製剤の有効性・安全性、費用対効果について、ファクトシートの作成を国立感染症研究所に依頼し、それ
を踏まえて再度議論を行うこととされた。
令和7年(2025年)
10月22日
第32回ワクチン評価小委員会において、提出されたファクトシート等に基づいた議論が行われ、今後の対
応方針として、母子免疫ワクチンについては、具体的な運用を含め、さらに予防接種基本方針部会において
検討すること、抗体製剤については今回の検討結果を予防接種基本方針部会に報告した上で同部会における
制度上の論点に係る議論を注視しつつ、必要に応じて費用対効果等について、小委員会において引き続き検
討することとされた。
11月19日
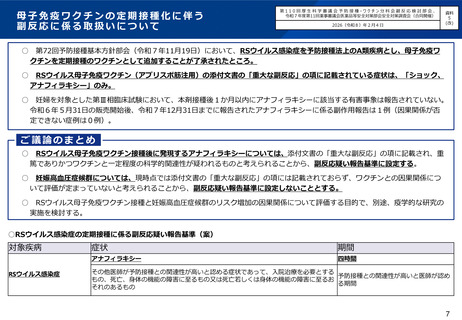
第72回基本方針部会において、RSウイルス感染症の予防接種法上の接種類型、母子免疫ワクチンの定期接
種化の開始時期や対象者等の具体的なプログラムについて事務局案を提示の上で議論し、了承された。抗体
製剤については予防接種法上の「ワクチン」と解釈することは困難であることから、今後予防接種法に基づ
く予防接種に用いる医薬品の範囲について議論を開始することとされた。
令和8年(2026年)
1月22日
第75回基本方針部会において、抗体製剤を予防接種法上の予防接種に用いる医薬品の一つに位置付けるこ
とについての議論を開始した。
5
平成14年(2002年)1月
モノクローナル抗体製剤パリビズマブが早産児等のRSウイルス感染症予防について薬事承認。
平成15年(2003年)10月
RSウイルス感染症が5類感染症の定点把握対象疾患(小児科定点)に追加。
平成25年(2013年)10月
第5回研究開発及び生産・流通部会(以下「生産・流通部会」)において、「RSウイルスワクチン」が開
発優先度の高いワクチンの一つに定められた。
12月
令和6年(2024年)1月
3月
3月14日
日本ワクチン産業協会の会員企業に対し、RSウイルスワクチン等の開発要請を行った。
母子免疫による新生児・乳児の予防を目的とするファイザー社の組換えRSウイルスワクチンが薬事承認。
薬事・食品衛生審議会 医薬品第二部会において、以下の事項が了承された。
・効果の持続期間が長いモノクローナル抗体製剤であるニルセビマブ(nirsevimab)の、重症化リスクの
高い児のほか、生後初回のRSウイルス流行期のすべての新生児及び乳幼児等を対象とした承認。
・モノクローナル抗体製剤パリビズマブの適応に、肺低形成等の重症化リスクの高い5疾患を伴う24か月
齢以下の児を追加。
第24回ワクチン評価小委員会においてRSウイルスワクチンの議論を開始。母子免疫について、疾病負荷は
一定程度明らかであるが、安全性についての情報収集や、抗体製剤(ニルセビマブ)の扱いが論点とされた。
9月4日
第27回ワクチン評価小委員会にて母子免疫ワクチン・抗体製剤の企業ヒアリングを実施。
11月21日
第28回ワクチン評価小委員会において、知見の一定の集積を踏まえ、疾病負荷、母子免疫ワクチン及び抗
体製剤の有効性・安全性、費用対効果について、ファクトシートの作成を国立感染症研究所に依頼し、それ
を踏まえて再度議論を行うこととされた。
令和7年(2025年)
10月22日
第32回ワクチン評価小委員会において、提出されたファクトシート等に基づいた議論が行われ、今後の対
応方針として、母子免疫ワクチンについては、具体的な運用を含め、さらに予防接種基本方針部会において
検討すること、抗体製剤については今回の検討結果を予防接種基本方針部会に報告した上で同部会における
制度上の論点に係る議論を注視しつつ、必要に応じて費用対効果等について、小委員会において引き続き検
討することとされた。
11月19日
第72回基本方針部会において、RSウイルス感染症の予防接種法上の接種類型、母子免疫ワクチンの定期接
種化の開始時期や対象者等の具体的なプログラムについて事務局案を提示の上で議論し、了承された。抗体
製剤については予防接種法上の「ワクチン」と解釈することは困難であることから、今後予防接種法に基づ
く予防接種に用いる医薬品の範囲について議論を開始することとされた。
令和8年(2026年)
1月22日
第75回基本方針部会において、抗体製剤を予防接種法上の予防接種に用いる医薬品の一つに位置付けるこ
とについての議論を開始した。
5