よむ、つかう、まなぶ。
費-4米国研究製薬工業協会 (5 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_60773.html |
| 出典情報 | 中央社会保険医療協議会 費用対効果評価専門部会(第71回 8/4)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
別添1
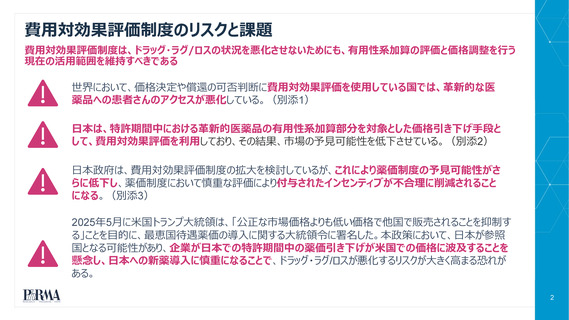
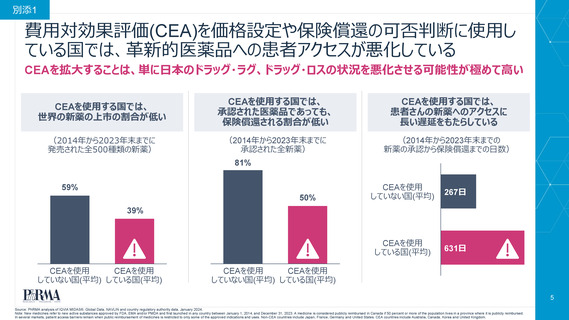
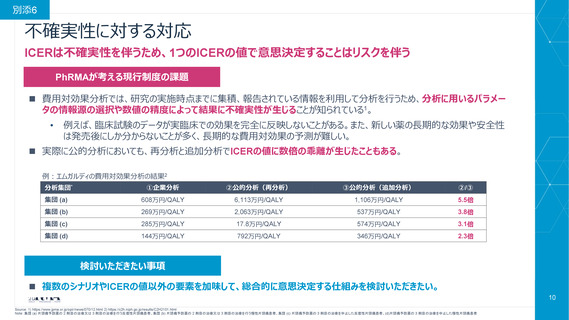
費用対効果評価(CEA)を価格設定や保険償還の可否判断に使用し
ている国では、革新的医薬品への患者アクセスが悪化している
CEAを拡大することは、単に日本のドラッグ・ラグ、ドラッグ・ロスの状況を悪化させる可能性が極めて高い
CEAを使用する国では、
世界の新薬の上市の割合が低い
CEAを使用する国では、
承認された医薬品であっても、
保険償還される割合が低い
CEAを使用する国では、
患者さんの新薬へのアクセスに
長い遅延をもたらしている
(2014年から2023年末までに
発売された全500種類の新薬)
(2014年から2023年末までに
承認された全新薬)
(2014年から2023年末までの
新薬の承認から保険償還までの日数)
81%
59%
50%
Non-CEA
Country
CEAを使用
A
Average
していない国(平均)
267日
CEA
Country
CEAを使用
B
Average
している国(平均)
631日
39%
CEAを使用
CEAを使用
Non-CEA
Country CEA
Country
していない国(平均)
している国(平均)
Average
Average
CEAを使用
CEAを使用
Non-CEA
Country CEA
Country
していない国(平均)
している国(平均)
Average
Average
5
Source: PhRMA analysis of IQVIA MIDAS®, Global Data, NAVLIN and country regulatory authority data, January 2024.
Note: New medicines refer to new active substances approved by FDA, EMA and/or PMDA and first launched in any country between January 1, 2014, and December 31, 2023. A medicine is considered publicly reimbursed in Canada if 50 percent or more of the population lives in a province where it is publicly reimbursed.
In several markets, patient access barriers remain when public reimbursement of medicines is restricted to only some of the approved indications and uses. Non-CEA countries include Japan, France, Germany and United States. CEA countries include Australia, Canada, Korea and United Kingdom.
費用対効果評価(CEA)を価格設定や保険償還の可否判断に使用し
ている国では、革新的医薬品への患者アクセスが悪化している
CEAを拡大することは、単に日本のドラッグ・ラグ、ドラッグ・ロスの状況を悪化させる可能性が極めて高い
CEAを使用する国では、
世界の新薬の上市の割合が低い
CEAを使用する国では、
承認された医薬品であっても、
保険償還される割合が低い
CEAを使用する国では、
患者さんの新薬へのアクセスに
長い遅延をもたらしている
(2014年から2023年末までに
発売された全500種類の新薬)
(2014年から2023年末までに
承認された全新薬)
(2014年から2023年末までの
新薬の承認から保険償還までの日数)
81%
59%
50%
Non-CEA
Country
CEAを使用
A
Average
していない国(平均)
267日
CEA
Country
CEAを使用
B
Average
している国(平均)
631日
39%
CEAを使用
CEAを使用
Non-CEA
Country CEA
Country
していない国(平均)
している国(平均)
Average
Average
CEAを使用
CEAを使用
Non-CEA
Country CEA
Country
していない国(平均)
している国(平均)
Average
Average
5
Source: PhRMA analysis of IQVIA MIDAS®, Global Data, NAVLIN and country regulatory authority data, January 2024.
Note: New medicines refer to new active substances approved by FDA, EMA and/or PMDA and first launched in any country between January 1, 2014, and December 31, 2023. A medicine is considered publicly reimbursed in Canada if 50 percent or more of the population lives in a province where it is publicly reimbursed.
In several markets, patient access barriers remain when public reimbursement of medicines is restricted to only some of the approved indications and uses. Non-CEA countries include Japan, France, Germany and United States. CEA countries include Australia, Canada, Korea and United Kingdom.