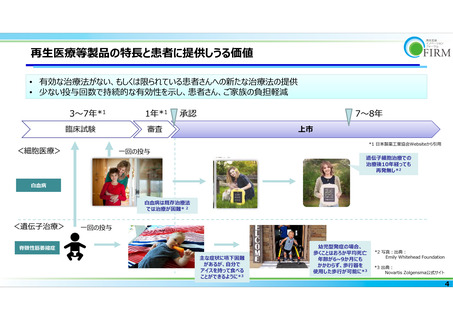
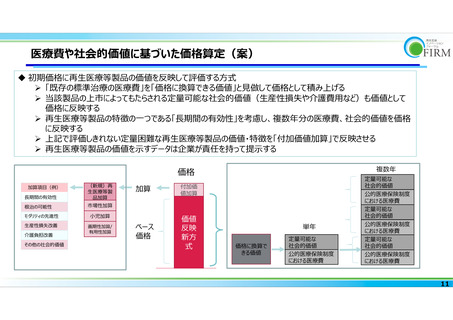
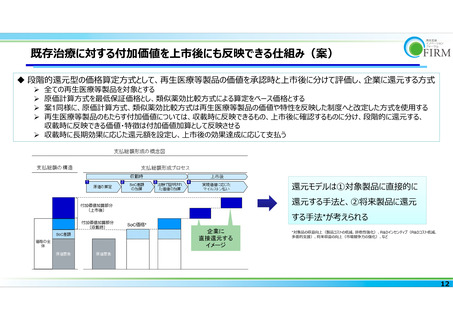
よむ、つかう、まなぶ。
薬-7再⽣医療イノベーションフォーラム[1.4MB] (16 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
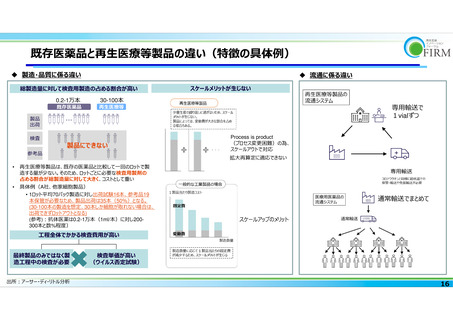
既存医薬品と再⽣医療等製品の違い(特徴の具体例)
製造・品質に係る違い
流通に係る違い
総製造量に対して検査⽤製造の占める割合が⾼い
0.2-1万本
既存医薬品
製品
出荷
検査
30-100本
•
専用輸送で
1vialずつ
再⽣医療等
…
製品にできない
参考品
•
スケールメリットが生じない
Process is product
(プロセス変更困難)の為、
スケールアウトで対応
拡大再算定に適応できない
再⽣医療等製品は、既存の医薬品と⽐較して⼀回のロットで製
造する量が少ない。そのため、ロットごとに必要な検査用製剤の
占める割合が総製造量に対して⼤きく、コストとして重い
具体例(A社、他家細胞製品)
• 1ロット平均70バック製造に対し出荷試験16本、参考品19
本保管が必要なため、製品出荷は35本(50%)となる。
(30-100本の製造を想定、30本しか細胞が取れない場合は、
出荷できずロットアウトとなる)
(参考)︓抗体医薬は0.2-1万本(1ml/本)に対し200300本と数%程度)
通常輸送でまとめて
スケールアップのメリット
工程全体でかかる検査費用が高い
最終製品のみではなく製
造工程中の検査が必要
出所︓アーサー・ディ・リトル分析
検査単価が高い
(ウイルス否定試験)
16
製造・品質に係る違い
流通に係る違い
総製造量に対して検査⽤製造の占める割合が⾼い
0.2-1万本
既存医薬品
製品
出荷
検査
30-100本
•
専用輸送で
1vialずつ
再⽣医療等
…
製品にできない
参考品
•
スケールメリットが生じない
Process is product
(プロセス変更困難)の為、
スケールアウトで対応
拡大再算定に適応できない
再⽣医療等製品は、既存の医薬品と⽐較して⼀回のロットで製
造する量が少ない。そのため、ロットごとに必要な検査用製剤の
占める割合が総製造量に対して⼤きく、コストとして重い
具体例(A社、他家細胞製品)
• 1ロット平均70バック製造に対し出荷試験16本、参考品19
本保管が必要なため、製品出荷は35本(50%)となる。
(30-100本の製造を想定、30本しか細胞が取れない場合は、
出荷できずロットアウトとなる)
(参考)︓抗体医薬は0.2-1万本(1ml/本)に対し200300本と数%程度)
通常輸送でまとめて
スケールアップのメリット
工程全体でかかる検査費用が高い
最終製品のみではなく製
造工程中の検査が必要
出所︓アーサー・ディ・リトル分析
検査単価が高い
(ウイルス否定試験)
16