よむ、つかう、まなぶ。
薬-7再⽣医療イノベーションフォーラム[1.4MB] (15 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_59378.html |
| 出典情報 | 中央社会保険医療協議会 薬価専門部会(第236回 7/9)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
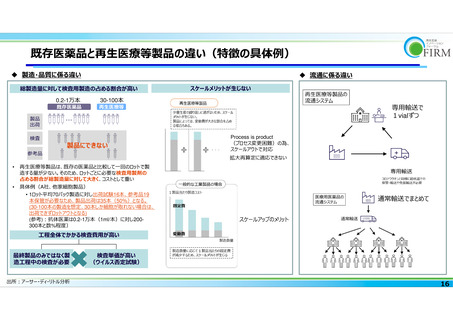
抗体医薬との製造〜投与の違い まとめ
接着培養系が必要
4
遺伝子編集等で
ライセンス料が⾼額になる
• 浮遊培養ではなく接着培養や三次元培養が必要であり、必要設備が大きくなりがち
✓
✓
✓
ウイルスベクター
• CAR-T細胞製造にはウイルスベクターの使⽤が必須(既存バイオ医薬では不要)であるが、ウイルスベク
ターの調達費用が高額
✓
プラスミド
• In vivo遺伝⼦治療薬製造では抗体のようにプラスミドを導⼊してから拡⼤培養するのでなく、拡大培養してか
らプラスミドを導入する。そのためプラスミドが⼤量に必要で費⽤が⾼額
✓
✓
7
固有のサプライチェーン構築が必要
• ⼀般製剤のように混載での納⼊が難しく、特殊な配送条件が必要(低温保管・輸送、免振、チャーター便で
の配送等)再⽣医療等製品に専⽤のサプライチェーン構築が必要
✓
8
投与に際しての手技が複雑
• 手術が必要であったり、製品の取り扱いなどで投与の⼿技が複雑。上市後も試⾏錯誤による改良も必要
• ⼿技料の問題や、投与体制整備のための継続的な費用が必要
✓
9
⻑期の症例追跡が必要
• ⻑期の症例追跡に関する費⽤が研究開発費に反映しきれていない(例︓フォローアップ体制整備等)
✓
製造が⾼難度でボラティリティが⾼い
• 個別性、製造難易度等から成功率が低く、製造ボラティリティが⾼い
• 製造ボラティリティに起因する損失が企業の持ち出しになり、製造原価に反映されない
• 製造プロセスが未確⽴で、開発中・上市後の製法変更コストが⽣じる可能性が既存医薬品より⾼い
✓
※組織移植、ex vivo遺伝⼦治療は「⾃家細胞」かつ「初期化なし」の⼯程を想定。細胞移植は「初期化なし」の⼯程を想定。出所︓有識者インタビューよりアーサー・ディ・リトル作成
自・他
• 製造した細胞そのものを投与するため、製品ごとに多様な品質保証試験が課される
• 品質検査のコストが高くなるが、費用として認められない場合がある
自・他
製品ごとに多様な品質検査が必要
自・他
6
10
✓
• CAR-T細胞の製造にあたっては、⾃社特許以外の遺伝⼦編集などの技術(例︓CRISPR等)が必須に
なる場合がある。使用には高額なライセンス費用・特許維持費が必要
自・他
5 既存医薬よりも
原材料費が⾼額/
既存医薬にない
原材料が必要
✓
in vivo
遺伝 子
3
• 自家の場合、患者個々の細胞調整が必要で、その後の製造プロセスも個別。製品毎・患者ごとの少量多品
種製造に対応した設備が必要で転用性が低いが、設備費用に反映されていない場合あり
• 他家の場合もドナーごとにばらつきがある
ex vivo
遺伝 子
製造の個別性が高く
規模の経済が働かない
✓
自・他
2
• 自家は病院で患者からの血液採取を⾏い、製造後に該当患者に投与する必要がある
• 他家も複数製造ごとにドナーからの入手が必要
• 採取時の⼿技料や、流通インフラ構築等の流通経費が反映されていない
自・他
患者/ドナーからの細胞/骨髄液調達&
自家では該当患者への投与が必要
細胞移植
1
概要と費用上の違い
組織移植
既存医薬(抗体医薬)との
製造〜投与プロセス上の違い
✓
✓
✓
✓
✓
✓
✓
15
接着培養系が必要
4
遺伝子編集等で
ライセンス料が⾼額になる
• 浮遊培養ではなく接着培養や三次元培養が必要であり、必要設備が大きくなりがち
✓
✓
✓
ウイルスベクター
• CAR-T細胞製造にはウイルスベクターの使⽤が必須(既存バイオ医薬では不要)であるが、ウイルスベク
ターの調達費用が高額
✓
プラスミド
• In vivo遺伝⼦治療薬製造では抗体のようにプラスミドを導⼊してから拡⼤培養するのでなく、拡大培養してか
らプラスミドを導入する。そのためプラスミドが⼤量に必要で費⽤が⾼額
✓
✓
7
固有のサプライチェーン構築が必要
• ⼀般製剤のように混載での納⼊が難しく、特殊な配送条件が必要(低温保管・輸送、免振、チャーター便で
の配送等)再⽣医療等製品に専⽤のサプライチェーン構築が必要
✓
8
投与に際しての手技が複雑
• 手術が必要であったり、製品の取り扱いなどで投与の⼿技が複雑。上市後も試⾏錯誤による改良も必要
• ⼿技料の問題や、投与体制整備のための継続的な費用が必要
✓
9
⻑期の症例追跡が必要
• ⻑期の症例追跡に関する費⽤が研究開発費に反映しきれていない(例︓フォローアップ体制整備等)
✓
製造が⾼難度でボラティリティが⾼い
• 個別性、製造難易度等から成功率が低く、製造ボラティリティが⾼い
• 製造ボラティリティに起因する損失が企業の持ち出しになり、製造原価に反映されない
• 製造プロセスが未確⽴で、開発中・上市後の製法変更コストが⽣じる可能性が既存医薬品より⾼い
✓
※組織移植、ex vivo遺伝⼦治療は「⾃家細胞」かつ「初期化なし」の⼯程を想定。細胞移植は「初期化なし」の⼯程を想定。出所︓有識者インタビューよりアーサー・ディ・リトル作成
自・他
• 製造した細胞そのものを投与するため、製品ごとに多様な品質保証試験が課される
• 品質検査のコストが高くなるが、費用として認められない場合がある
自・他
製品ごとに多様な品質検査が必要
自・他
6
10
✓
• CAR-T細胞の製造にあたっては、⾃社特許以外の遺伝⼦編集などの技術(例︓CRISPR等)が必須に
なる場合がある。使用には高額なライセンス費用・特許維持費が必要
自・他
5 既存医薬よりも
原材料費が⾼額/
既存医薬にない
原材料が必要
✓
in vivo
遺伝 子
3
• 自家の場合、患者個々の細胞調整が必要で、その後の製造プロセスも個別。製品毎・患者ごとの少量多品
種製造に対応した設備が必要で転用性が低いが、設備費用に反映されていない場合あり
• 他家の場合もドナーごとにばらつきがある
ex vivo
遺伝 子
製造の個別性が高く
規模の経済が働かない
✓
自・他
2
• 自家は病院で患者からの血液採取を⾏い、製造後に該当患者に投与する必要がある
• 他家も複数製造ごとにドナーからの入手が必要
• 採取時の⼿技料や、流通インフラ構築等の流通経費が反映されていない
自・他
患者/ドナーからの細胞/骨髄液調達&
自家では該当患者への投与が必要
細胞移植
1
概要と費用上の違い
組織移植
既存医薬(抗体医薬)との
製造〜投与プロセス上の違い
✓
✓
✓
✓
✓
✓
✓
15