よむ、つかう、まなぶ。
【資料2-3】血管内視鏡承認基準 (9 ページ)
出典
| 公開元URL | https://www.mhlw.go.jp/stf/newpage_58452.html |
| 出典情報 | 薬事審議会 医療機器・体外診断薬部会(令和7年度第2回 6/2)《厚生労働省》 |
ページ画像
ダウンロードした画像を利用する際は「出典情報」を明記してください。
低解像度画像をダウンロード
プレーンテキスト
資料テキストはコンピュータによる自動処理で生成されており、完全に資料と一致しない場合があります。
テキストをコピーしてご利用いただく際は資料と付け合わせてご確認ください。
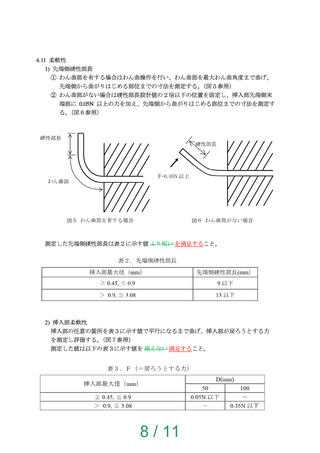
図7 挿入部柔軟性
4.12 腐食抵抗性
内視鏡に金属材料が使用され、かつその部位が一般的な使用方法によって間接的又は直
接的に血液に接触する場合、当該使用条件下で金属部位に腐食の兆候を認めてはならな
い。
なお、既承認品との比較により腐食兆候の程度が同等以下であることを確認する方法を
用いてもよい。
試験は、
「ISO 10555-1 付属書 A」の試験方法に基づき実施する。
4.13 生物学的安全性
挿入部の外表面に使用される材料は、
「JIS T 0993-1」に従って生物学的安全性を評価し、
生物学的安全性が確保されていなければならない。
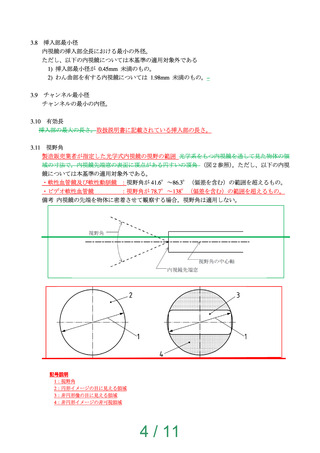
4.14 エンドトキシン
滅菌された製品の場合は、血管内視鏡の血液と接触する部位を「第 十五 十八改正日本薬局方」
のエンドトキシン試験法等 ※によって試験を行い、エンドトキシンは 20EU/device 未満で
なければならない。
※
測定のために使用する試料溶液については平成 15 年 3 月 19 日付け事務連絡「生物学的安全性試験の基
本的考え方に関する参考資料について」を参考とする。
4.15 環境上の要求事項
内視鏡は、
「JIS T 0601-2-18」の要求事項に適合しなければならない。
4.16 ルアーコネクタ
コネクタを持つ内視鏡にあっては、コネクタが雌コネクタであり、「ISO 594-1」及び「ISO
594-2」「ISO 80369-7」に適合しなければならない。
9 / 11
4.12 腐食抵抗性
内視鏡に金属材料が使用され、かつその部位が一般的な使用方法によって間接的又は直
接的に血液に接触する場合、当該使用条件下で金属部位に腐食の兆候を認めてはならな
い。
なお、既承認品との比較により腐食兆候の程度が同等以下であることを確認する方法を
用いてもよい。
試験は、
「ISO 10555-1 付属書 A」の試験方法に基づき実施する。
4.13 生物学的安全性
挿入部の外表面に使用される材料は、
「JIS T 0993-1」に従って生物学的安全性を評価し、
生物学的安全性が確保されていなければならない。
4.14 エンドトキシン
滅菌された製品の場合は、血管内視鏡の血液と接触する部位を「第 十五 十八改正日本薬局方」
のエンドトキシン試験法等 ※によって試験を行い、エンドトキシンは 20EU/device 未満で
なければならない。
※
測定のために使用する試料溶液については平成 15 年 3 月 19 日付け事務連絡「生物学的安全性試験の基
本的考え方に関する参考資料について」を参考とする。
4.15 環境上の要求事項
内視鏡は、
「JIS T 0601-2-18」の要求事項に適合しなければならない。
4.16 ルアーコネクタ
コネクタを持つ内視鏡にあっては、コネクタが雌コネクタであり、「ISO 594-1」及び「ISO
594-2」「ISO 80369-7」に適合しなければならない。
9 / 11